Kuldoksiidi (III) (Au2O3) struktuur, omadused, nomenklatuur ja kasutusalad
The kuldoksiid (III) on anorgaaniline ühend, mille keemiline valem on Au2O3. Teoreetiliselt võib eeldada, et selle olemus on kovalentne. Teatud ioonse iseloomu olemasolu oma tahkes aines ei saa siiski täielikult ära visata; või see, mis on sama, eeldada, et puudub katse3+ aniooni O kõrval2-.
Võib tunduda vastuoluline, et kuld, mis on väärismetall, võib roosteda. Normaalsetes tingimustes ei saa kuldnõusid (nagu alloleval pildil olevad tähed) hapnikuga kokkupuutel atmosfääris oksüdeerida; kui kiiritatakse ultraviolettkiirgusega osooni juuresolekul, siis OR3, pilt on erinev.

Kui kuldsed tähed oleksid nendele tingimustele allutatud, muutuksid nad Au-le omased punakaspruunid2O3.
Teised selle oksiidi saamise meetodid hõlmavad nimetatud tähtede keemilist töötlemist; näiteks kuldmassi muundamine vastavaks kloriidiks, AuCl3.
Pärast seda AuCl3, ja ülejäänud moodustunud võimalikud kuldsed soolad, lisatakse tugev aluseline sööde; ja sellega saad hüdraaditud oksiidi või hüdroksiidi, Au (OH)3. Lõpuks, viimane ühend dehüdreeritakse termiliselt Au saamiseks2O3.
Indeks
- 1 Kuldoksiidi struktuur (III)
- 1.1 Elektroonilised aspektid
- 1.2 Hüdraadid
- 2 Atribuudid
- 2.1 Füüsiline välimus
- 2.2 Molekulmass
- 2.3 Tihedus
- 2.4 Sulamistemperatuur
- 2.5 Püsivus
- 2.6 Lahustuvus
- 3 Nomenklatuur
- 4 Kasutamine
- 4.1 Prillide värvimine
- 4.2 Aurate sünteesimine ja kulla täitmine
- 4.3 Paigaldatud monokihtide käitlemine
- 5 Viited
Kuldoksiidi struktuur (III)
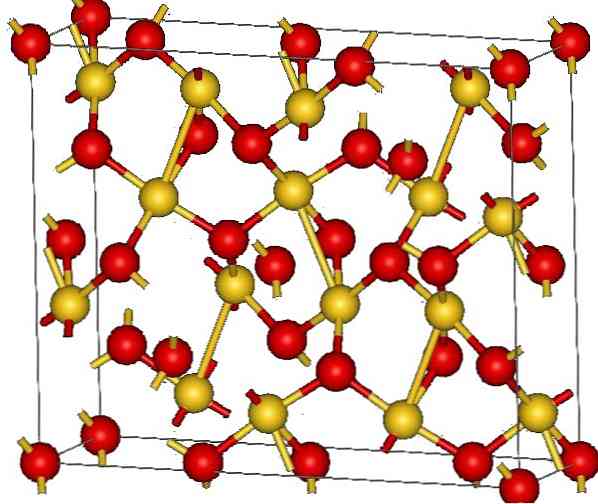
Kuld (III) oksiidi kristallstruktuur on näidatud ülemises pildis. On näidatud kulla ja hapniku aatomite paigutamine tahkesse ainesse kas neutraalsete aatomitena (kovalentne tahke aine) või ioonidena (ioonse tahke ainena). Kindlasti piisab Au-O-linkide kõrvaldamisest või paigutamisest igal juhul.
Kujutise kohaselt eeldatakse, et kovalentne iseloom on valdav (mis oleks loogiline). Sel põhjusel on esindatud aatomid ja sidemed vastavalt sfääride ja baaridega. Kuldsed sfäärid vastavad kulla aatomitele (AuIII-O) ja punakas kuni hapniku aatomid.
Kui te vaatate hoolikalt, näete, et seal on AuO üksusi4, mis on ühendatud hapniku aatomitega. Teine viis visualiseerida oleks see, et iga Au3+ ümbritseb nelja O2-; Muidugi, ioonilisest vaatenurgast.
See struktuur on kristalne, sest aatomid on tellitud sama pikamaa mustriga. Seega vastab selle ühtne rakk romboedrilisele kristallilisele süsteemile (sama nagu ülemisest pildist). Seega, kõik Au2O3 oleks võimalik ehitada, kui kõik need ühikuelemendi sfäärid on ruumis jaotatud.
Elektroonilised aspektid
Kuld on siirdemetall ja on oodata, et selle 5d orbitaalid on otseselt seotud hapniku aatomi 2p orbitaalidega. Nende orbitaalide kattumine peaks teoreetiliselt tekitama juhtivusribasid, mis muudaksid Au2O3 tahkes pooljuhtis.
Seega Au tõeline struktuur2O3 see on veelgi keerulisem.
Hüdraadid
Kuldoksiid võib säilitada veemolekule oma romboedrilistes kristallides, mis tekitab hüdraate. Selliste hüdraatide moodustumisel muutub struktuur amorfseks, see tähendab, et see on häirimata.
Selliste hüdraatide keemiline valem võib olla üks järgmistest, mis tegelikult ei ole sügavalt selgitatud: Au2O3∙ zH2O (z = 1, 2, 3 jne), Au (OH)3, või AuxOja(OH)z.
Valem Au (OH)3 kujutab nimetatud hüdraatide tegeliku koostise ülemäärast lihtsustamist. Seda seetõttu, et kuldhüdroksiidis (III) on teadlased leidnud ka Au olemasolu2O3; ja seetõttu on mõttekas seda töödelda eraldiseisva üleminekumetalli hüdroksiidina.
Teisest küljest, tahke aine valemiga AuxOja(OH)z oodata amorfset struktuuri; sellest sõltub see koefitsientidest x, ja ja z, mille variatsioonid tekitaksid kõikvõimalikke struktuure, mis vaevalt näitasid kristalset mustrit.
Omadused
Füüsiline välimus
See on punakaspruun tahke aine.
Molekulmass
441,93 g / mol.
Tihedus
11,34 g / ml.
Sulamistemperatuur
See sulab ja laguneb 160 ° C juures. Seetõttu puudub see keemistemperatuur, nii et see oksiid ei jõua kunagi keemistemperatuurini.
Stabiilsus
Au2O3 see on termodünaamiliselt ebastabiilne, sest nagu alguses mainitud, kullal ei ole normaalsetes temperatuuritingimustes oksüdeerumist. Nii on see kergesti vähendatav, et saada taas üllaseks kuldiks.
Mida kõrgem on temperatuur, seda kiirem on reaktsioon, mida nimetatakse termiliseks lagunemiseks. Niisiis, Au2O3 160 ° C juures laguneb metalli kulla tootmiseks ja vabastab molekulaarse hapniku:
2 Au2O3 => 4 Au + 3 O2
Väga sarnane reaktsioon võib tekkida teiste ühendite puhul, mis soodustavad nimetatud redutseerimist. Miks vähendada? Kuna kuld naaseb, et saada elektronid, mida hapnik sellest ära võttis; mis on sama, mis ütleb, et see kaotab sideme hapnikuga.
Lahustuvus
See on vees lahustumatu tahke aine. Siiski lahustub see vesinikkloriidhappes ja lämmastikhappes kulla kloriidide ja nitraatide moodustumise tõttu.
Nomenklatuur
Kuldoksiid (III) on varude nomenklatuuriga reguleeritav nimetus. Teised viited sellele on järgmised:
-Traditsiooniline nomenklatuur: aureric oxide, sest valents 3+ on kulla puhul kõrgeim.
-Süstemaatiline nomenklatuur: dioro trioksiid.
Kasutamine
Prillide värvimine
Üks selle silmapaistvamaid kasutusvõimalusi on pakkuda teatud materjalidele, näiteks klaasidele punaseid värve, lisaks anda teatud kulla aatomitele omased omadused..
Aurate sünteesimine ja kulla täitmine
Kui Au on lisatud2O3 keskkonda, kus see on lahustuv, ja metallide juuresolekul võivad aurad pärast tugeva aluse lisamist sadestuda; mille moodustavad AuO anioonid4- metallist katioonide ettevõttes.
Ka Au2O3 reageerib ammoniaagiga, et moodustada kuldne ahendav ühend Au2O3(NH3)4. Selle nimi tuleneb asjaolust, et see on väga plahvatusohtlik.
Paigaldatud monokihtide käitlemine
Kullal ja selle oksiidil ei ole teatud ühendid, nagu dialküüldisulfiidid, RSSR samal viisil adsorbeerunud. Kui see adsorptsioon toimub, moodustub spontaanselt Au-S side, kus väävliaatomil on ja määratletakse nimetatud pinna keemilised omadused sõltuvalt funktsionaalsest rühmast, millega see on seotud..
RSSR ei saa Au-sse adsorbeerida2O3, kuid metallist kuld. Seega, kui kulla pind ja selle oksüdatsiooniaste on muudetud, samuti Au osakeste või kihtide suurus.2O3, on võimalik kujundada heterogeensem pind.
See pind Au2O3-AuSR suhtleb teatud elektrooniliste seadmete metallioksiididega, arendades seega tulevikus targemaid pindu.
Viited
- Wikipedia. (2018). Kuld (III) oksiid. Välja otsitud andmebaasist: en.wikipedia.org
- Keemiline preparaat (2018). Kuldoksiid (III). Sissenõutud: formulaacionquimica.com
- D. Michaud. (24. oktoober 2016). Kuldoksiidid. 911 Metallurg. Välja otsitud andmebaasist: 911metallurgist.com
- Shi, R. Asahi ja C. Stampfl. (2007). Kuldoksiidide omadused Au2O3 ja Au2O: Esimese põhimõtte uurimine. Ameerika füüsiline selts.
- Cook, Kevin M. (2013). Kuldoksiid kui regioselektiivse pinna keemia varjatud kiht. Teesid ja väitekirja. Raamat 1460.


