Hõbeoksiidi (Ag2O) struktuur, omadused, nomenklatuur ja kasutusalad
The hõbeoksiid on anorgaaniline ühend, mille keemiline valem on Ag2O. Aatomit ühendav jõud on täiesti iooniline; seetõttu koosneb see ioonilisest tahkest ainest, kus on kahe Ag katiooni suhe+ koos aniooni Oga2-.
Oksiidi anioon, O2-, see tuleneb pinna hõbedaste aatomite koostoimes keskkonna hapnikuga; väga sarnaselt raua ja paljude teiste metallidega. Hõbedane tükk või ehted roostetamise ja murenemise asemel muutub mustaks, mis on iseloomulik hõbeoksiidile.

Näiteks ülaloleval pildil on näha roostes hõbedane tass. Pange tähele selle mustunud pinda, kuigi see säilitab endiselt mõned dekoratiivsed läige; seetõttu võib isegi roostes hõbedat esemeid pidada dekoratiivseks kasutamiseks piisavalt atraktiivseks.
Hõbeoksiidi omadused on sellised, et nad ei pruugi esmapilgul rikkuda algset metallpinda. See moodustub toatemperatuuril, lihtsalt kokkupuutes õhus oleva hapnikuga; ja veelgi huvitavam, võib see laguneda kõrgel temperatuuril (üle 200 ° C).
See tähendab, et pildi klaasi hoidmisel ja intensiivse leegi soojuse rakendamisel taastuks see hõbedase läike. Seetõttu on selle moodustumine termodünaamiliselt pöörduv protsess.
Hõbeda oksiidil on ka muud omadused ja lisaks lihtsale Ag-valemile2Või hõlmab see keerulisi struktuuriorganisatsioone ja rohkelt tahkeid aineid. Ag2Või on see Agi kõrval2O3, kõige tüüpilisem hõbeoksiidid.
Indeks
- 1 Hõbeoksiidi struktuur
- 1.1 Valencia arvu muutused
- 2 Füüsikalised ja keemilised omadused
- 2.1 Molekulmass
- 2.2 Välimus
- 2.3 Tihedus
- 2.4 Sulamistemperatuur
- 2,5 Kps
- 2.6 Lahustuvus
- 2.7 Kovalentne iseloom
- 2.8 Lagunemine
- 3 Nomenklatuur
- 3.1 Valencias I ja III
- 3.2 Komplekssete hõbeoksiidide süstemaatiline nomenklatuur
- 4 Kasutamine
- 5 Viited
Hõbeoksiidi struktuur
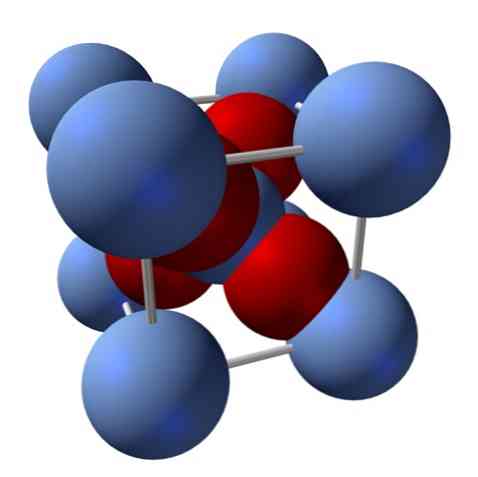
Kuidas on selle struktuur? Nagu alguses mainitud, on see ioonne tahke aine. Sel põhjusel ei saa olla struktuuris kovalentseid sidemeid Ag-O ega Ag = O; sest kui oleks, muutuksid selle oksiidi omadused drastiliselt. See on siis Ag ioonid+ ja O2- suhe 2: 1 ja tekib elektrostaatiline atraktsioon.
Hõbedaoksiidi struktuuri määrab kindlaks see, kuidas ioon jõud jõuavad Ag ioonidesse+ ja O2-.
Ülemises pildis on näiteks ühikrakk kuubilise kristallilise süsteemi jaoks: Ag katioonid+ on hõbeda sinised sfäärid ja O2- punakad sfäärid.
Kui loete sfääride arvu, leiad, et esmapilgul on üheksa hõbedast sinist ja nelja punast värvi. Arvesse võetakse siiski ainult kuubis olevate sfääride fragmente; nende lugemine, mis on kogu sfääride fraktsioonid, peab olema täidetud Ag: 2: 1 suhtega2O.
AgO tetraeedri struktuuriüksuse kordamine4 ümbritsetud nelja teise Agiga+, kogu must tahke aine on ehitatud (kõrvaldades lüngad või ebakorrapärasused, mida need kristallid võivad olla).
Valencia arvu muutused
Keskenduge nüüd mitte AgO tetraeederile4 kuid joonel AgOAg (vaadake ülemise kuubi tipusid) on see, et hõbeoksiidi tahke aine koosneb teisest vaatenurgast mitmest lineaarselt (kuigi kaldu) paigutatud ioonkihist. Kõik see on "molekulaarse" geomeetria tõttu Agi ümber+.
Ülaltoodut on kinnitanud mitmed selle ioonse struktuuri uuringud.
Hõbe töötab peamiselt valentsiga +1, kuna elektroni kaotamisel on selle tulemuseks olev elektrooniline konfiguratsioon [Kr] 4d10, mis on väga stabiilne. Muud valentsid, nagu Ag2+ ja Ag3+ nad on vähem stabiilsed, kuna nad kaotavad orbitaalidest elektronid peaaegu täielikult täis.
Ag ioon3+, siiski on see Agiga võrreldes suhteliselt vähem ebastabiilne2+. Tegelikult võib see olla Agi firmas+ Struktuuri keemiline rikastamine.
Selle elektrooniline konfiguratsioon on [Kr] 4d8, koos paaritu elektronidega sellisel viisil, mis annab sellele teatud stabiilsuse.
Erinevalt lineaarsetest geomeetriast Agioonide ümber+, on leitud, et Ag ioonid3+ See on ruudukujuline. Seetõttu on hõbeoksiid Ag ioonidega3+ koosneksid AgO ruutudest koosnevatest kihtidest4 (mitte tetraeedriga), mis on elektrostaatiliselt ühendatud AgOAg liinidega; Selline on Agi puhul4O4 Ag2O ∙ Ag2O3 monokliinilise struktuuriga.
Füüsikalised ja keemilised omadused

Kui te kriimustate põhikujutise hõbedase tassi pinda, saad sa tahke, mis ei ole ainult must, vaid ka pruunid või pruunid toonid (ülemine pilt). Mõned selle hetkedest teatatud füüsikalised ja keemilised omadused on järgmised:
Molekulmass
231,735 g / mol
Välimus
Tahke mustpruun pulbrina (pange tähele, et vaatamata sellele, et see on ioonne tahke aine, puudub kristalliline välimus). See on lõhnatu ja segatud veega annab selle metallist maitse
Tihedus
7,14 g / ml.
Sulamistemperatuur
277-300 ° C. Kindlasti sulab see tahkeks hõbedaks; see tähendab, et see laguneb tõenäoliselt enne vedela oksiidi moodustamist.
Kps
1,52 ∙ 10-8 vees temperatuuril 20 ° C. Seetõttu on see vees vaevalt lahustuv ühend.
Lahustuvus
Kui vaatate hoolikalt oma struktuuri kujutist, siis leiate, et Agi sfäärid2+ ja O2- Nad ei nõustu peaaegu suurusega. Selle tulemusena võivad kristallvõre sisemusse tungida ainult väikesed molekulid, mis muudab selle lahustumatuks peaaegu kõigis lahustites; välja arvatud need, kus see reageerib, näiteks alused ja happed.
Kovalentne iseloom
Kuigi on korduvalt öeldud, et hõbeoksiid on ioonne ühend, on teatavad omadused, nagu selle madal sulamistemperatuur, vastuolus selle väitega.
Kindlasti ei lõhu kovalentse iseloomu arvestamine selle struktuuri selgitamist, piisab selle lisamisest Ag-i struktuuri.2Või sfääride ja baaride mudel kovalentsete sidemete näitamiseks.
Samuti on tetrahüdrokaad ja ruudukujulised lennukid AgO4, nagu ka AgOAg liinid, oleksid need seotud kovalentsete (või kovalentsete) ioonidega.
Seda silmas pidades, Ag2Või see oleks tegelikult polümeer. Siiski on soovitatav seda pidada kovalentse iseloomuga ioonse tahke ainena (mille seos on tänapäeval ikka veel probleem).
Lagunemine
Kõigepealt mainiti, et selle moodustumine on termodünaamiliselt pöörduv, nii et see neelab soojust, et taastada metallist seisund. Seda kõike saab väljendada kahe sellise keemilise võrrandiga:
4Ag (s) + O2(g) => 2Ag2O (s) + Q
2Ag2O (s) + Q => 4Ag (s) + O2(g)
Kui Q tähistab võrrandis olevat soojust. See seletab, miks roostetatud hõbedase tassiga põletav tulekahju tagastab oma hõbedase sära.
Seetõttu on raske eeldada, et Ag on olemas2O (l), kuna see laguneks koheselt kuumusega; kui rõhk on liiga suur, et saada pruuni must vedelik.
Nomenklatuur
Kui võeti kasutusele Ag ioonide võimalus2+ ja Ag3+ lisaks tavalisele ja domineerivale Agile+, termin "hõbeoksiid" hakkab tunduma ebapiisavaks, et viidata Agile2O.
Seda seetõttu, et Ag ioon+ on rohkem kui teised, nii et Ag võetakse2Või kui ainus oksiid; mis ei ole üldse õige.
Kui arvate, et Ag2+ kui selle ebastabiilsus on praktiliselt olematu, siis on olemas ainult valentsid +1 ja +3; see tähendab, et Ag (I) ja Ag (III).
Valencias I ja III
Olles Ag (I) kõige vähem valents, nimetatakse see nimele, lisades sufiksi -oso oma nimele argentum. Niisiis, Ag2Või on see: argentosoksiid või süstemaatilise nomenklatuuri kohaselt diplomaatide monoksiid.
Kui Ag (III) on täielikult ignoreeritud, peab selle traditsiooniline nomenklatuur olema: hõbeoksiid argentiinoksiidi asemel.
Teisest küljest, kui Ag (III) on suurem valents, lisatakse selle nimetusele sufiks -ico. Niisiis, Ag2O3 on: hõbeoksiid (2 Ag ioonid)3+ kolme O-ga2-). Samuti oleks selle nimi süstemaatilise nomenklatuuri järgi: diplata trioxide.
Kui täheldatakse Ag struktuuri2O3, võib eeldada, et see on osooni oksüdatsiooni tulemus, OR3, hapniku asemel. Seetõttu peab selle kovalentne iseloom olema suurem, kuna see on kovalentne ühend Ag-O-O-O-Ag või Ag-O sidemetega.3-Ag.
Komplekssete hõbeoksiidide süstemaatiline nomenklatuur
AgO, kirjutatud ka kui Ag4O4 Ag2O ∙ Ag2O3, see on hõbeoksiid (I, III), kuna sellel on mõlemad valentsid +1 ja +3. Süstemaatilise nomenklatuuri järgi on selle nimi: tetraplaadi tetraoksiid.
See nomenklatuur on väga kasulik teiste stöhhiomeetriliselt keerukamate hõbeoksiidide puhul. Oletame näiteks, et kaks tahket ainet 2Ag2O ∙ Ag2O3 ja Ag2O ∙ 3Ag2O3.
Esimese kirjutamine sobivamal viisil oleks: Ag6O5 (Ag ja O aatomite loendamine ja lisamine). Tema nimi oleks siis heksaplaadi pentoksiid. Pange tähele, et selle oksiidi hõbedane koostis on vähem rikkalik kui Ag2O (6: 5) < 2:1).
Teise tahke teksti kirjutades oleks see järgmine: Ag8O10. Selle nimi oleks oktaplaadi dekaoksiid (suhe 8: 10 või 4: 5). See hüpoteetiline hõbeoksiid oleks "väga oksüdeeritud".
Kasutamine
Praegu tehakse ikka veel uuringuid hõbeoksiidi uute ja keerukate kasutusviiside otsimiseks. Mõned selle kasutusalad on loetletud allpool:
-Tollens-reaktiivi moodustamiseks lahustatakse see ammoniaagis, ammooniumnitraadis ja vees. See reaktiiv on kasulik vahend orgaaniliste keemia laborite kvalitatiivsetes analüüsides. See võimaldab määrata proovis aldehüüdide olemasolu, positiivne vastus on "hõbedase peegli" moodustumine katseklaasis..
-Koos metallilise tsingiga moodustab see hõbedase tsinkoksiidi esmased patareid. See on ilmselt üks kõige levinum ja koduneim kasutus.
-See toimib gaasipuhastina, absorbeerides näiteks CO2. Soojendamisel vabastab ta lõksus gaasid ja seda saab korduvalt kasutada.
-Hõbeda antimikroobsete omaduste tõttu on selle oksiid kasulik bioanalüüsi ja pinnase puhastamise uuringutes.
-See on kerge oksüdeeriv aine, mis on võimeline oksüdeerima aldehüüde karboksüülhapeteks. Seda kasutatakse ka Hofmanni reaktsioonis (tertsiaarsed amiinid) ja osalevad teistes orgaanilistes reaktsioonides, kas reagendina või katalüsaatorina..
Viited
- Bergstresser M. (2018). Hõbeoksiid: valem, lagunemine ja moodustumine. Uuring. Välja otsitud: study.com
- Mahtude III / 17E-17F-41C autorid ja toimetajad. (s.f.). Hõbeoksiidid (Ag (x) O (y)) kristallstruktuur, võre parameetrid. (Arvandmed ja funktsionaalsed suhted teaduses ja tehnoloogias), vol 41C. Springer, Berliin, Heidelberg.
- Mahendra Kumar Trivedi, Rama Mohan Tallapragada, Alice Branton, Dahryn Trivedi, Gopal Nayak, Omprakash Latiyal, Snehasis Jana. (2015). Biofieldi energiaravi potentsiaalne mõju hõbedaoksiidi pulbri füüsikalistele ja termilistele omadustele. International Journal of Biomedical Science and Engineering. Vol. 3, No. 5, pp. 62-68. doi: 10.11648 / j.ijbse.20150305.11
- Sullivan R. (2012). Hõbeoksiidi lagunemine. Oregoni ülikool Välja otsitud andmebaasist: chemdemos.uoregon.edu
- Flint, Deyanda. (24. aprill 2014). Hõbeoksiidi patareide kasutamine. Science. Välja otsitud andmebaasist: sciencing.com
- Salman Montasir E. (2016). Hõbeda oksiidi (Ag2o) mõnede optiliste omaduste uurimine, kasutades UVVisible spektrofotomeetrit. [PDF] Välja otsitud aadressilt: iosrjournals.org
- Bard Allen J. (1985). Standardne potentsiaal vesilahuses. Marcel Dekker. Välja otsitud aadressilt books.google.co.ve


