Berülliumoksiidi (BeO) struktuur, omadused ja kasutusalad
The berülliumoksiid (BeO) on keraamiline materjal, millel on lisaks kõrge tugevusele ja elektrilisele vastupidavusele kõrge soojusjuhtivus, mis muudab selle osaks tuumareaktoritest, ületades isegi selle viimase omaduse metalle..
Lisaks kasulikkusele sünteetilise materjalina võib seda leida ka looduses, kuigi see on haruldane. Selle juhtimine peab toimuma ettevaatlikult, sest see on võimeline inimeste tervist tõsiselt kahjustama.
Tänapäeva maailmas on täheldatud, kuidas tehnoloogiaettevõtetega seotud teadlased on läbi viinud uuringuid, et arendada välja arenenud materjale üsna spetsialiseerunud rakenduste jaoks, näiteks need, mis vastavad pooljuhtmaterjalidele ja kosmosetööstuse materjalidele..
Selle tulemuseks on ainete avastamine, mis tänu oma väga kasulikele omadustele ja nende kõrge vastupidavusele on andnud meile võimaluse aegsasti edasi liikuda, võimaldades meil oma tehnoloogiat kõrgemale tasemele viia..
Indeks
- 1 Keemiline struktuur
- 2 Atribuudid
- 2.1 Elektrijuhtivus
- 2.2 Soojusjuhtivus
- 2.3 Optilised omadused
- 2.4 Terviseriskid
- 3 Kasutamine
- 3.1 Elektroonilised rakendused
- 3.2 Tuumarakendused
- 3.3 Muud rakendused
- 4 Viited
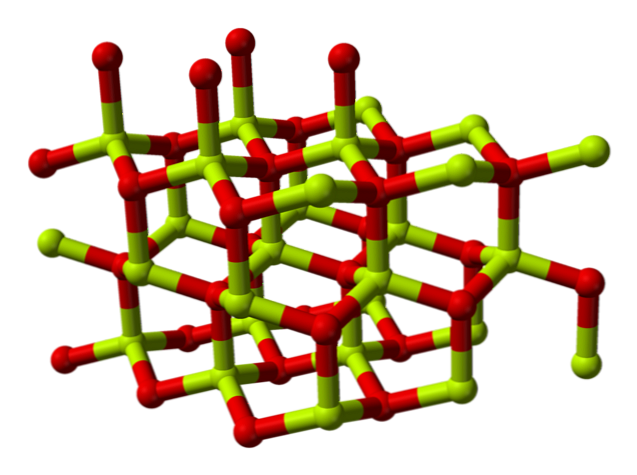
Keemiline struktuur
Berylliumoksiidi molekul (nimetatakse ka "Berilia") See koosneb berülliumi aatomist ja hapniku aatomist, mis mõlemad on koordineeritud tetraedrilise orientatsiooniga ja on kristalliseerunud heksagonaalsetes kristalsetes struktuurides, mida nimetatakse wurtzites.
Nendel kristallidel on tetraedrilised keskused, mis asuvad Be2+ ja O2-. Kõrgetel temperatuuridel muutub berülliumoksiidi struktuur tetragonaalseks.
Berülliumoksiidi saamine saavutatakse kolme meetodi abil: berülliumkarbonaadi kaltsineerimine, berülliumhüdroksiidi dehüdratsioon või berülliummetalli süttimine. Kõrgetel temperatuuridel moodustunud berülliumoksiid on inertne, kuid seda võib lahustada mitme ühendiga.
BeCO3 + Kuumus → BeO + CO2 (Kaltsineerimine)
Be (OH)2 → BeO + H2O (dehüdratsioon)
2 Be + O2 → 2 BeO (süüde)
Lõpuks võib berülliumoksiidi aurustada ja sellises olekus esitatakse see diatoommolekulide kujul..
Omadused
Berülliumoksiid esineb looduses bromelliidina, valge mineraalina, mis on leitud mangaani raua mõnedes keerulistes ladestustes, kuid mis on sagedamini sünteetilisel kujul: valge amorfne tahke aine, mis on valmistatud pulbri kujul..
Samuti annavad tootmisprotsessi käigus püütud lisandid oksüdiproovile erinevaid värve.
Selle sulamistemperatuur on 2507 ° C, keemispunkt on 3900 ° C ja selle tihedus on 3,01 g / cm3.
Samamoodi on selle keemiline stabiilsus märkimisväärselt kõrge, reageerides ainult veeaurule temperatuuridel, mis on lähedal 1000 ° C-le, ning võivad vastu panna süsiniku vähendamise protsessidele ja sulametallide rünnakutele kõrgel temperatuuril.
Lisaks sellele on selle mehaaniline tugevus korralik ja seda saab täiustada kaubanduslikuks otstarbeks sobivate konstruktsioonide ja valmistamisega.
Elektrijuhtivus
Berülliumoksiid on väga stabiilne keraamiline materjal ja seetõttu on selle elektriline vastupidavus suhteliselt kõrge, mis muudab selle alumiiniumoksiidiks üheks parimaks elektriisolatsioonimaterjaliks..
Seetõttu kasutatakse seda materjali tavapäraste kõrgsageduslike elektriseadmete jaoks.
Soojusjuhtivus
Berülliumoksiidil on soojusjuhtivuse poolest suur eelis: seda tuntakse kui teist parimat soojust juhtivat materjali mittemetallide hulgas, mida ületab ainult teemant, materjal on oluliselt kallim ja haruldane.
Mis puutub metallidesse, siis ainult vase ja hõbe ülekanne soojendab paremini juhtivusega kui berülliumoksiid, muutes selle väga soovitavaks materjaliks.
Tänu oma suurepärastele soojusjuhtimisomadustele on see aine olnud seotud tulekindlate materjalide tootmisega.
Optilised omadused
Kristalliliste omaduste tõttu kasutatakse berylliumoksiidi läbipaistva materjali kandmiseks ultraviolettkiirgusele teatud lameekraanides ja fotogalvaanilistes elementides..
Samuti saab valmistada väga kõrge kvaliteediga kristalle, nii et need omadused paranevad vastavalt kasutatud tootmisprotsessile.
Terviseohud
Berülliumoksiid on ühend, mida tuleb käsitseda väga ettevaatlikult, sest kõigepealt on sellel kantserogeensed omadused, mis on seotud selle materjali pulbrite või aurude pideva sissehingamisega..
Väikesed osakesed nendes oksiidi faasides kleepuvad kopsudesse ja võivad tekitada kasvajate moodustumist või beryllioosina tuntud haigust..
Berülioos on haigus, mille keskmine suremus on põhjustanud ebatõhusat hingamist, köha, kehakaalu langust ja palavikku ning granuloomide teket kopsudes või muudes kahjustatud organites..
Beryliumoksiidi ja naha vahetus kokkupuutel terviseohtudega, kuna see on söövitav ja ärritav ning võib kahjustada naha pinda ja limaskestasid. Selle materjaliga töötamisel, eriti pulbri kujul, tuleb hingamisteede ja käte kaitset kaitsta.
Kasutamine
Berülliumoksiidi kasutused on peamiselt jagatud kolme: elektroonilised, tuuma- ja muud rakendused.
Elektroonilised rakendused
Võime kanda soojust kõrgele tasemele ja selle hea elektriline takistus on teinud berülliumoksiidist soojuskraanina suure kasulikkuse..
Selle kasutamine on tõendatud ka suure võimsusega arvutite sees olevates ahelates, lisaks seadmetele, mis tegelevad suure elektrivooluga.
Berülliumoksiid on röntgenkiirte ja mikrolaineahjude jaoks läbipaistev, mistõttu seda kasutatakse nende kiirgustüüpide, samuti antennide, sidesüsteemide ja mikrolaineahjude vastu..
Tuumarakendused
Selle võime mõõta neutronit ja säilitada oma struktuuri kiirguse pommitamise tõttu on teinud berüllioksiidi kaasatuks tuumareaktorite ehitamisse ning seda saab kasutada ka kõrgetel temperatuuridel reaktorites, mis on jahutatud gaasidega.
Muud rakendused
Berülliumoksiidi madal tihedus on tekitanud huvi lennundus- ja sõjaliste tehnoloogiate tööstuse vastu, kuna see võib kujutada endast väikese kaaluga võimalust rakettmootorites ja kuulikindlates vestides..
Lõpuks on seda hiljuti rakendatud metallitööstuses metallide sulandamisel tulekindla materjalina.
Viited
- PubChem. (s.f.). Berülliumoksiid. Välja otsitud aadressilt pubchem.ncbi.nlm.nih.gov
- Loe. (s.f.). Beryllia / berülliumoksiid (BeO). Taastati reade.com-st
- Research, C. (s.f.). Berülliumoksiid - beryllia. Välja otsitud aadressilt azom.com
- Services, N. J. (s.f.). Berülliumoksiid. Välja otsitud aadressilt nj.gov
- Wikipedia. (s.f.). Berülliumoksiid. Välja otsitud aadressilt en.wikipedia.org


