Booroksiidi (B2O3) struktuur, omadused, nomenklatuur ja kasutusalad
The booroksiid või booranhüdriid on anorgaaniline ühend, mille keemiline valem on B2O3. Perioodilise lauaplaadi boori ja hapniku elementidena ning isegi nende vastavate rühmade juhtidena ei ole nende vahelise elektronegatiivsuse erinevus väga suur; seetõttu on oodata, et B2O3 olema kovalentne.
B2O3 see valmistatakse, lahustades booraks kontsentreeritud väävelhappes sulatusahjus ja temperatuuril 750 ° C; boorhappe, B (OH) termiliselt veetustav3, temperatuuril umbes 300 ° C; või see võib olla moodustatud ka diboraanreaktsiooni saadusena (B2H6) hapnikuga.

Booroksiidil võib olla poolläbipaistev klaasjas või kristalne välimus; Viimast võib saada pulbrina jahvatamise teel (ülemine pilt).
Kuigi see ei pruugi esmapilgul tunduda, peetakse seda B2O3 kui üks kõige keerulisemaid anorgaanilisi oksiide; mitte ainult struktuurilisest vaatepunktist, vaid ka klaaside ja keraamika varieeruvate omaduste tõttu, millele nad lisatakse oma maatriksile.
Indeks
- 1 Booroksiidi struktuur
- 1.1 Ühik BO3
- 1.2 Kristallstruktuur
- 1.3 Klaasstruktuur
- 2 Atribuudid
- 2.1 Füüsiline välimus
- 2.2 Molekulmass
- 2.3 Maitse
- 2.4 Tihedus
- 2.5 Sulamistemperatuur
- 2.6 Keemistemperatuur
- 2.7 Stabiilsus
- 3 Nomenklatuur
- 4 Kasutamine
- 4.1 Boortrihaliidide süntees
- 4.2 Insektitsiid
- 4.3 Metalloksiidide lahusti: klaaside, keraamika ja boorisulamite moodustumine
- 4.4 Sideaine
- 5 Viited
Booroksiidi struktuur
BO üksus3
B2O3 on kovalentne tahke aine, nii et teoreetiliselt ei ole selle struktuuris B-iioone3+ ega O2-, kuid B-O lingid. Boor, vastavalt valentssideme teooriale (VTE), võib moodustada ainult kolm kovalentset sidet; sel juhul kolm B-O-linki. Selle tulemusena peab eeldatav geomeetria olema trigonaalne, BO3.
BO molekul3 see on puudulik elektronides, eriti hapniku aatomites; kuid paljud neist võivad üksteisega suhelda, et nimetatud puudust pakkuda. Niisiis, kolmnurgad BO3 nad liidetakse, jagades hapniku silla, ja nad jagunevad ruumis kolmnurkse rea võrkudena, mille lennukid on orienteeritud erinevatel viisidel.
Kristallstruktuur
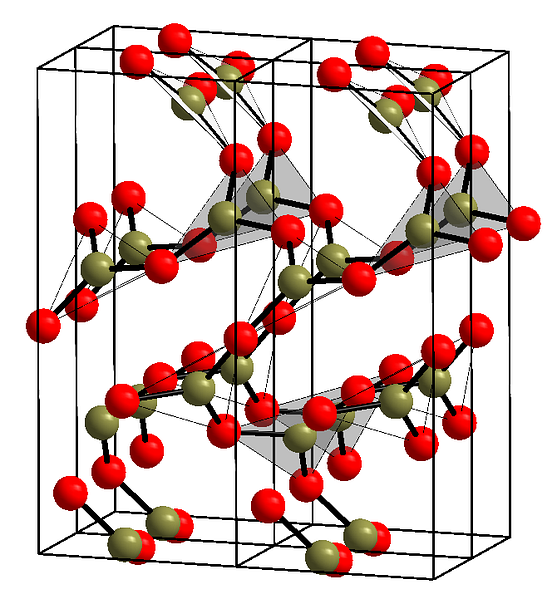
Ülemises pildis on näidatud kolmnurkse üksusega BO-d3. Kui te vaatate hoolikalt, ei viita kõik lennukite näod lugejale, vaid teisele küljele. Nende nägude orientatsioonid võivad olla vastutavad selle eest, kuidas B on määratletud2O3 teatud temperatuuril ja rõhul.
Kui nendel võrkudel on pikadevahelised struktuurid, on see kristalne tahke aine, mida saab konstrueerida selle ühikrakust. Siin on öeldud, et B on2O3 Sellel on kaks kristalset polümorfi: a ja β.
Α-B2O3 toimub ümbritseva keskkonna rõhul (1 atm) ja on kineetiliselt ebastabiilne; tegelikult on see üks põhjustest, miks booroksiid on tõenäoliselt raske kristalliseerumise ühend.
Teine polümorf, β-B2O3, see saadakse suurel rõhul GPa vahemikus; seetõttu peab selle tihedus olema suurem kui α-B2O3.
Klaasiline struktuur
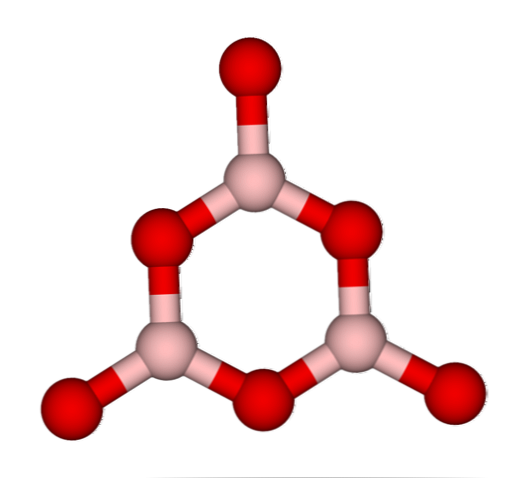
Võrgud BO3 loomulikult kalduvad nad amorfseid struktuure vastu võtma; need on sellised, millel puudub muster, mis kirjeldab tahke aine molekule või ioone. B sünteesides2O3 selle valdav vorm on amorfne ja mitte kristalne; õigete sõnadega: see on tahket klaasjasem kui kristalne.
Siis öeldakse, et B2O3 see on klaaskeha või amorfne, kui selle BO võrgud on3 Nad on räpased. Mitte ainult seda, vaid ka neid, kuidas nad kokku tulevad. Selle asemel, et nad oleksid paigutatud trigonaalsesse geomeetriasse, on nad seotud sellega, et luua, mida teadlased nimetavad boroksoolitsükliks (ülemine pilt).
Pange tähele ilmset erinevust kolmnurk- ja kuusnurkade vahel. Kolmnurksed iseloomustavad B-d2O3 kristalliline ja kuusnurkne2O3 klaasjas Teine võimalus sellele amorfsele faasile viitamiseks on boorklaas või valem: g-B2O3 ('g' pärineb sõnast glassy, inglise keeles).
Seega on G-B võrgud2O3 need koosnevad booroksoolrõngastest, mitte BO-ühikutest3. Kuid g-B2O3 võib kristalluda a-B-ks2O3, mis tähendaks rõngaste vastastikust muundumist kolmnurgadeks ja määrataks ka saavutatud kristalliseerumise määra.
Omadused
Füüsiline välimus
See on värvitu ja klaasjas tahke aine. Kristallilises vormis on see valge.
Molekulmass
69,6182 g / mol.
Maitse
Veidi mõru
Tihedus
-Kristalliline: 2,46 g / ml.
-Klaas: 1,80 g / ml.
Sulamistemperatuur
Sellel ei ole täielikult määratletud sulamistemperatuuri, sest see sõltub kristallilisest või klaaskehast. Puhtalt kristalne vorm sulab 450 ° C juures; klaasjas vorm sulab temperatuurivahemikus 300 kuni 700 ºC.
Keemistemperatuur
Jällegi ei vasta teatatud väärtused sellele väärtusele. Ilmselt keeb vedel booroksiid (kristallidest või klaasist sulanud) 1860 ° C juures.
Stabiilsus
Seda tuleb hoida kuivana, kuna see neelab niiskust, et muuta see boorhappeks, B (OH)3.
Nomenklatuur
Booroksiidi võib nimetada muul viisil, näiteks:
-Diboro-trioksiid (süstemaatiline nomenklatuur).
-Booroksiid (III) (varude nomenklatuur).
-Booroksiid (traditsiooniline nomenklatuur).
Kasutamine
Mõned booroksiidi kasutused on:
Boortrihaliidide süntees
Alates B2O3 võib olla sünteesitud boortrihaliidid, BX3 (X = F, Cl ja Br). Need ühendid on Lewise happed ja nendega on võimalik lisada boori aatomeid teatud molekulidesse, et saada teisi uute omadustega derivaate..
Insektitsiid
Tahke segu boorhappega, B2O3-B (OH)3, kujutab valemit, mida kasutatakse kodumaise insektitsiidina.
Metalloksiidide lahusti: klaaside, keraamika ja boorisulamite moodustumine
Vedel booroksiid on võimeline metallioksiide lahustama. Saadud segust saadakse pärast jahutamist boor ja metallid.
Sõltuvalt B kogusest2O3 kasutatav, samuti tehnika ja metallioksiidi tüüp, saad rohkelt erinevaid klaase (borosilikaate), keraamikat (nitrideid ja boorkarbiide) ja sulameid (kui kasutatakse ainult metalle).
Üldiselt on klaasist või keraamikast suurem tugevus ja tugevus ning suurem vastupidavus. Prillide puhul kasutatakse neid optiliste läätsede ja teleskoobide ning elektrooniliste seadmete jaoks.
Binder
Terasest sulatusahjude konstrueerimisel kasutatakse tulekindlaid telliseid, millel on magneesiumalused. Neis kasutatakse sideainena booroksiidi, mis aitab neid tihedalt siduda.
Viited
- Shiver & Atkins. (2008). Anorgaaniline keemia (Neljas väljaanne). Mc Grawi mägi.
- Wikipedia. (2019). Boortrioksiid. Välja otsitud andmebaasist: en.wikipedia.org
- PubChem. (2019). Booroksiid. Välja otsitud andmebaasist: pubchem.ncbi.nlm.nih.gov
- Rio Tinto. (2019). Boriksioksiid. 20 Mule Team Borax. Välja otsitud andmebaasist: borax.com
- A. Mukhanov, O. O. Kurakevich ja V. L. Solozhenko. (s.f.). Boori (III) oksiidi kõvadus. LPMTMCNRS, Université Paris Nord, Villetaneuse, Prantsusmaa.
- Hansen T. (2015). B2O3 (Booroksiid). Välja otsitud andmebaasist: digitalfire.com


