Orgaanilised soolad füüsikalised ja keemilised omadused, kasutusalad ja näited
The orgaanilised soolad need on arvukate omadustega ioonühendite tihe arv. Nad pärinevad eelnevalt orgaanilisest ühendist, mis on läbinud transformatsiooni, mis võimaldab tal olla laengu kandja ja ka selle keemiline identiteet sõltub seotud ioonist..
Alloleval pildil on esitatud kaks väga üldist orgaaniliste soolade keemilist valemit. Esimest, R-AX, tõlgendatakse ühendina, mille süsinikstruktuuril on aatom või rühm A, millel on positiivne laeng + või negatiivne (-).
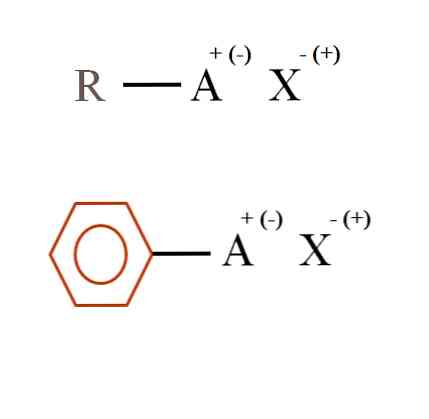
Nagu näha, on R ja A, R-A vahel kovalentne side, kuid omakorda A omab formaalset laengut, mis meelitab (või tõrjub) X iooni. Laengu märk sõltub A olemusest ja keemilisest keskkonnast..
Kui A oleks positiivne, siis kui palju X-ga see on? Ainult üks, arvestades elektroneutraalsuse põhimõtet (+ 1-1 = 0). Kuid mis on X identiteet? Anioon X võib olla CO32-, vajab kahte katiooni RA+; halogeeni: F-, Cl-, Br-, jne; või isegi teine RA ühend-. Valikud on arvutamatud.
Samuti võib orgaanilisel soolal olla aromaatne iseloom, mida on illustreeritud pruunis benseenitsüklis. Vase bensoaatsool (II), (C6H5COO)2Cu koosneb näiteks kahest aromaatsest rõngast koos negatiivselt laetud karboksüülrühmadega, mis interakteeruvad Cuationiga.2+.
Indeks
- 1 Füüsikalised ja keemilised omadused
- 1.1 Suured molekulmassid
- 1.2 Amfifiilid ja pindaktiivsed ained
- 1.3 Kõrge keemis- või sulamispunktid
- 1.4. Happelisus ja aluselikkus
- 2 Kasutamine
- 3 Orgaaniliste soolade näited
- 3.1 Karboksülaadid
- 3.2 Liitiumdiakrülaadid
- 3.3 Sulfooniumi soolad
- 3.4 Oksooniumi soolad
- 3.5 Amiinisoolad
- 3.6 Diasooniumisoolad
- 4 Viited
Füüsikalised ja keemilised omadused
Joonisel võib öelda, et orgaanilised soolad koosnevad kolmest komponendist: orgaanilisest, R või Ar (aromaatne tsükkel), aatomist või rühmast, millel on ioonne laeng A, ja vastasioon X.
Nii nagu keemiline identiteet ja struktuur on määratletud selliste komponentidega, sõltuvad nende omadused nende omadustest.
Sellest võib kokku võtta teatud üldised omadused, mis vastavad enamusele nendest sooladest.
Suured molekulmassid
Eeldades mono- või polüvalentseid anorgaanilisi X-anioone, on orgaanilistel sooladel tavaliselt palju suuremad molekulmassid kui anorgaanilised soolad. See on peamiselt tingitud süsiniku skelettist, mille lihtsad C-C sidemed ja nende vesinikuaatomid annavad ühendile palju massi..
Seetõttu on nad R või Ar vastutavad nende suure molekulmassi eest.
Amfifiilid ja pindaktiivsed ained
Orgaanilised soolad on amfifiilsed ühendid, st nende struktuuridel on nii hüdrofiilsed kui ka hüdrofoobsed otsad.
Mis on sellised äärmused? R või Ar esindavad hüdrofoobset otsa, kuna nende C ja H aatomitel ei ole suurt afiinsust vee molekulide suhtes.
A+(-), laengut kandev aatom või rühm on hüdrofiilne ots, kuna see soodustab dipolaarset momenti ja suhtleb vee moodustavate dipoolidega (RA+ OH2).
Kui hüdrofiilsed ja hüdrofoobsed piirkonnad on polariseeritud, muutub amfifiilsoolaks pindaktiivne aine, aine, mida kasutatakse laialdaselt detergentide valmistamiseks ja demulgaatorid.
Kõrge keemis- või sulamispunktid
Sarnaselt anorgaanilistele sooladele on orgaanilistel sooladel ka kõrge sulamis- ja keemispunkt, mis on tingitud vedelas või tahkes faasis valitsevatest elektrostaatilistest jõududest..
Siiski, millel on orgaaniline komponent R või Ar, muud tüüpi Van der Waalsi jõud (Londoni jõud, dipool-dipool, vesinik sillad), mis konkureerivad teatud viisil elektrostaatiliste omadustega.
Sel põhjusel on orgaaniliste soolade tahked või vedelad struktuurid esiteks keerulisemad ja varieeruvad. Mõned neist võivad isegi käituda vedelkristallid.
Happelisus ja aluselisus
Orgaanilised soolad on tavaliselt tugevamad happed või alused kui anorgaanilised soolad. Seda seetõttu, et A-l, näiteks amiinisooladel, on positiivne laeng, mis on tingitud selle sidumisest täiendava vesinikuga: A+-Siis annetage baasiga kokkupuutel prooton tagasi neutraalseks ühendiks:
RA+H + B => RA + HB
H kuulub A-le, kuid see on kirjutatud nii, et see sekkub neutraliseerimisreaktsiooni.
Teisest küljest, RA+ see võib olla suur molekul, mis ei ole võimeline moodustama tahket ainet hüdroksüülaniooni või hüdroksüül-OH-ga piisavalt stabiilse kristallvõrguga.-.
Kui see nii on, soola RA+OH- see käitub nagu tugev alus; isegi kui aluseline nagu NaOH või KOH:
RA+OH- + HCl => RACl + H2O
Märkus keemilise võrrandi kohta, mida Cl anioon- see asendab OH-i-, moodustades soola RA+Cl-.
Kasutamine
Orgaaniliste soolade kasutamine varieerub sõltuvalt R, Ar, A ja X identsusest. Peale selle sõltub ka nende rakendamine, milleks need on määratud, ka nende moodustunud tahke või vedeliku tüübist. Mõned selles osas on üldised:
-Need on reagendid teiste orgaaniliste ühendite sünteesiks. RAX võib toimida R-ahela "doonorina", mis lisatakse teisele ühendile, mis asendab head väljaminevat rühma.
-Need on pindaktiivsed ained, mistõttu neid saab kasutada ka määrdeainetena. Selleks kasutatakse karboksülaatide metalli sooli.
-Need võimaldavad sünteesida mitmesuguseid värve.
Orgaaniliste soolade näited
Karboksülaadid
Karboksüülhapped reageerivad hüdroksiidiga neutraliseerimisreaktsioonis, põhjustades karboksülaatide sooli: RCOO- M+; kus M+ See võib olla mistahes metalli katioon (Na+, Pb2+, K+, jne) või NH ammooniumi katioon4+.
Rasvhapped on pika ahelaga alifaatsed karboksüülhapped, nad võivad olla küllastunud ja küllastumata. Palmitiinhape (CH) on küllastunud3(CH2)14COOH). See pärineb palmitaatsoolast, stearhape (CH3(CH2)16COOH moodustab stearaatsoola. Seebid koosnevad nendest sooladest.
Bensoehappe puhul C6H5COOH (kus C6H5- see on benseenitsükkel), kui see reageerib alusega, moodustab bensoaatsoolad. Kõigis karboksülaatides on -COO rühm- tähistab A (RAX).
Liitiumdiakupupraadid
Liitiumdiakupraat on kasulik orgaanilises sünteesis. Selle valem on [R-Cu-R]-Li+, milles vase aatom kannab negatiivset laengut. Siin kujutab vask kujutise aatomit A.
Sulfooniumisoolad
Need moodustuvad orgaanilise sulfidi reaktsioonist alküülhalogeniidiga:
R2S + R'X => R2R'S+X
Nende soolade puhul on väävliaatomil positiivne ametlik laeng (S+) millel on kolm kovalentset sidet.
Oksooniumisoolad
Samuti reageerivad eetrid (sulfiidide hapnikuga ühendatud analoogid) hüdroksiididega, moodustades oksoonisoolad:
ROR '+ HBr <=> RO+HR '+ Br-
HBr happeline prooton on seotud eetri hapniku aatomiga (R2O+-H), laadides selle positiivselt.
Amiinisoolad
Amiinid võivad olla primaarsed, sekundaarsed, tertsiaarsed või kvaternaarsed, samuti nende soolad. Kõiki neid iseloomustab H-aatom, mis on seotud lämmastikuaatomiga.
Niisiis, RNH3+X- see on primaarne amiinsool; R2NH2+X-, sekundaarse amiini; R3NH+X-, tertsiaarsest amiinist; ja R4N+X-, kvaternaarse amiini (kvaternaarne ammooniumsool) \ t.
Diasooniumisoolad
Lõpuks, diasooniumsoolad (RN2+X-) või arildiasoonium (ArN)2+X-) on paljude orgaaniliste ühendite, eriti asovärvide lähtepunkt.
Viited
- Francis A. Carey. Orgaaniline keemia (Kuues väljaanne., Lk. 604-605, 697-698, 924). Mc Grawi mägi.
- Graham Solomons T.W., Craig B. Fryhle. Orgaaniline keemia. Amiinid (10. trükk.). Wiley Plus.
- Wikipedia. (2018). Sool (keemia). Vastu võetud: en.wikipedia.org
- Steven A. Hardinger. (2017). Illustreeritud orgaanilise keemia sõnastik: soolad. Välja otsitud andmebaasist: chem.ucla.edu
- Chevron Oronite. (2011). Karboksülaadid. [PDF] Välja otsitud aadressilt: oronite.com


