Osmolaarsuse valem, kuidas seda arvutada ja erinevust osmolaalsusega
The osmolaarsus on parameeter, mis mõõdab keemilise ühendi kontsentratsiooni liitri lahuses, kui see aitab kaasa nimetatud lahuse osmootse rõhuna tuntud kolligatiivsele omadusele..
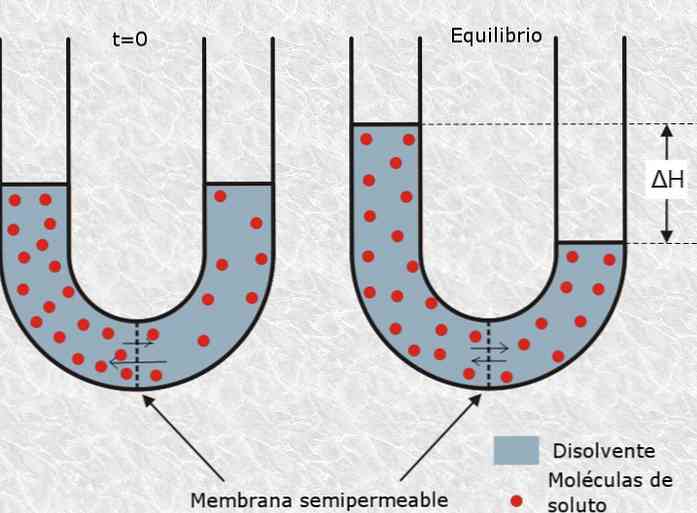
Siin osmootne rõhk lahuse viitab surve suurust vaja peatada osmoosi protsess, mis on defineeritud kui selektiivsed läbipääsu osakesed lahustiga läbi poolläbilaskva või poorse membraani lahusest väiksema kontsentratsiooniga kontsentreeritumasse.
Samuti on üksus, mida kasutatakse lahustunud osakeste koguse väljendamiseks, osmol (mille sümbol on Osm), mis ei kuulu rahvusvahelisse ühikute süsteemi (SI), mida kasutatakse peaaegu kogu maailmas. Seega määratakse lahuses lahustunud aine kontsentratsioon osmoolide ühikutes liitri kohta (Osm / l)..
Indeks
- 1 Valem
- 1.1 Osmolaarsusvalemi muutujate määratlemine
- 2 Kuidas seda arvutada?
- 3 Osmolaarsuse ja osmolaalsuse erinevused
- 4 Viited
Valem
Nagu eelnevalt mainitud, väljendatakse osmolaarsust (tuntud ka kui osmootset kontsentratsiooni) ühikutes, mis on määratletud kui Osm / l. Selle põhjuseks on seos osmootse rõhu määramise ja osmoosiga lahusti difusiooni mõõtmisega.
Praktikas saab osmootse kontsentratsiooni määrata osmomeetri abil füüsilise koguse järgi.
Osmomeetri on instrument, mida kasutatakse mõõtmiseks osmootne rõhk lahuse ning määramist muud Kolligatiivsete omadused (nagu aururõhk, suurenenud keev või külmumispunkti alandavat), saades väärtuse lahuse osmolaarsus.
Sel viisil kasutatakse selle mõõtmisparameetri arvutamiseks järgmist valemit, mis võtab arvesse kõiki tegureid, mis võivad seda omadust mõjutada..
Osmolaarsus = ΣφiniCi
Selles võrrandis luuakse osmolaarsus summana, mis saadakse kõigi kolme erineva parameetriga saadud väärtuste korrutamisel, mis on allpool määratletud.
Osmolaarsusvalemi muutujate määratlemine
Esimese osmootse koefitsient, esindajad kreeka tähega φ (fii), mis selgitab, kui palju ideaalne lahendus käitumine või, teisisõnu, mil määral mitte-Ideaalisuus mis avalduvad lahustunud aine lahuses on ära.
Kõige lihtsamal viisil viitab φ soluudi dissotsiatsiooni astmele, mille väärtus võib olla nulli ja ühe vahel, kus seadme maksimaalne väärtus kujutab endast dissotsiatsiooni 100%; see tähendab absoluutne.
Mõnel juhul - nagu sahharoos - see väärtus ületab ühtsuse; teistel juhtudel, näiteks soolade puhul, põhjustavad elektrostaatiliste interaktsioonide või jõudude mõju osmootse koefitsiendi, mille väärtus on väiksem kui ühtsus, isegi kui absoluutne dissotsiatsioon esineb.
Teisest küljest, n väärtus näitab osakeste kogust, milles molekul võib olla dissotsieerunud. Iooniliste liikide puhul on näidetena toodud naatriumkloriid (NaCl), mille väärtus n on kaks; arvestades, et ioniseerimata glükoosimolekulis on n väärtuseks üks.
Lõpuks näitab c väärtus lahustunud aine kontsentratsiooni, väljendatuna molaarsetes ühikutes; ja alaindeks i viitab konkreetse soluudi identiteedile, kuid see peab olema sama, kui korrutada ülalmainitud kolm tegurit ja saada seega osmolaarsus.
Kuidas seda arvutada?
Juhul KBr ioonilise ühendi (tuntud kui kaaliumbromiidi), kui meil on lahus kontsentratsiooniga 1 mol / l KBr vees, siis järeldub, et käesolev osmolaarsus võrdne 2 osmol / l.
Selle põhjuseks on tugev elektrolüütide iseloom, mis soodustab selle täielikku dissotsiatsiooni vees ja võimaldab vabastada kaks sõltumatut iooni (K+ ja Br-), millel on mõni elektrilaeng, nii et iga KBr mool võrdub kahe osmooliga lahuses.
Analoogselt lahuse puhul, mille kontsentratsioon on võrdne 1 mol / l BaCl-ga2 (tuntud kui baariumkloriid) vees, selle osmolaarsus on võrdne 3 osmol / l.
Seda seetõttu, et vabastatakse kolm sõltumatut iooni: Ba-ioon2+ ja kaks Cl-iooni-. Seejärel iga mool BaCl2 on võrdne kolme osmooliga lahuses.
Teisest küljest ei läbinud mitteioonsed liigid sellist dissotsiatsiooni ja nad tekitavad iga osaliidi kohta iga soluudi mooli. Glükoosilahuse puhul, mille kontsentratsioon on 1 mol / l, võrdub see 1 osmooli / l lahusega..
Osmolaarsuse ja osmolaalsuse erinevused
Osmol defineeritakse osakeste arv, mis on lahustatud võrdses mahus 22,4 l lahusti allutatakse temperatuurile 0 ° C ja tekitamises osmootne rõhk võrdne 1 atm. Pange tähele, et need osakesed peetakse osmootselt aktiivsete.
Selles mõttes viitavad osmolaarsuse ja osmolaalsuse poolest tuntud omadused samale mõõtmisele: lahustunud aine kontsentratsioon lahuses või muul viisil lahuses sisalduvate lahustunud osakeste sisaldus..
Oluline erinevus osmolaarsuse ja osmolaalsuse vahel on üksustes, kus igaüks neist on esindatud:
Osmolaarsus väljendatakse aine kogus lahuse ruumala kohta (st osmol / l), samas osmolaalsuseks väljendatakse aine kogus per lahusti kaal (st osmol / kg lahuses).
Praktikas kasutatakse mõlemat parameetrit ükskõikselt, isegi kui need ilmnevad erinevates üksustes, kuna erinevate mõõtmiste kogumahu vahel on ebatõenäoline erinevus..
Viited
- Wikipedia. (s.f.). Osmootne kontsentratsioon. Välja otsitud es.wikipedia.org-st
- Chang, R. (2007). Keemia, üheksas väljaanne. Mehhiko: McGraw-Hill.
- Evans, D. H. (2008). Osmootne ja iooniline regulatsioon: rakud ja loomad. Välja otsitud aadressilt books.google.co.ve
- Potts, W. T. ja Parry, W. (2016). Osmootne ja iooniline regulatsioon loomadel. Välja otsitud aadressilt books.google.co.ve
- Armitage, K. (2012). Uuringud üldbioloogias. Välja otsitud aadressilt books.google.co.ve


