Tsüklohekseeni struktuur, omadused, süntees ja kasutusalad
The tsüklohekseen on alkeen või tsükliline olefiin, mille molekulaarne valem on C6H10. See koosneb värvitu vedelikust, mis ei lahustu vees ja seguneb paljude orgaaniliste lahustitega. Seda iseloomustab see, et see on tuleohtlik ja looduses on see tavaliselt kivisöetõrvas..
Tsüklohekseen sünteesitakse benseeni osalise hüdrogeenimise ja alkoholtsükloheksanooli dehüdreerimise teel; see tähendab rohkem roostes vormis. Sarnaselt teiste tsükloalkeenidega toimub see ka elektrofiilse lisamise ja vabade radikaalidega; näiteks halogeenimisreaktsioon.
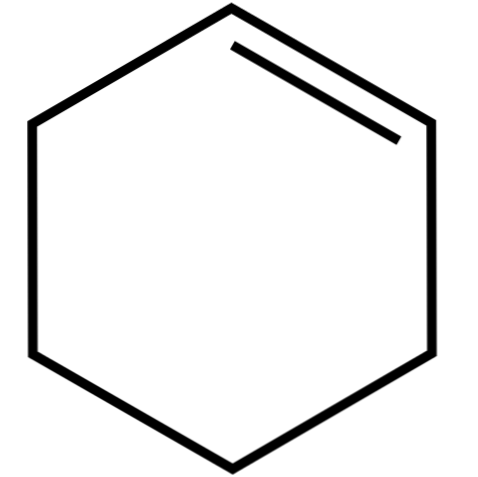
See tsükliline alkeen (ülemine pilt) moodustab aseotroopseid segusid (mida ei saa eraldada destilleerimise teel) madalamate alkoholide ja äädikhappega. See ei ole pikaajaline ladustamine väga stabiilne, sest see laguneb päikesevalguse ja ultraviolettkiirguse toimel.
Tsüklohekseeni kasutatakse lahustina ja seetõttu on sellel mitmeid rakendusi, näiteks: kõrge oktaanarvuga bensiini stabilisaator ja õlide ekstraheerimine..
Kõige tähtsam on aga see, et tsüklohekseen toimib paljude kasulike ühendite, sealhulgas tsükloheksanooni, adipiinhappe, maleiinhappe, tsükloheksaani, butadieeni, tsükloheksüülkarboksüülhappe jms tootmiseks..
Indeks
- 1 Tsüklohekseeni struktuur
- 1.1 Molekulidevaheline interaktsioon
- 2 Atribuudid
- 2.1 Keemilised nimetused
- 2.2 Molekulmass
- 2.3 Füüsiline välimus
- 2.4 Lõhn
- 2.5 Keemistemperatuur
- 2.6 Sulamistemperatuur
- 2.7 Leekpunkt
- 2.8 Vees lahustuv
- 2.9 Lahustuvus orgaanilistes lahustites
- 2.10 Tihedus
- 2.11 Auru tihedus
- 2.12 Aururõhk
- 2.13 Isesüttimine
- 2.14 Lagunemine
- 2.15 Viskoossus
- 2.16 Põlemissoojus
- 2.17 Aurustumistemperatuur
- 2.18 Pinna pinge
- 2.19 Polümerisatsioon
- 2.20 Lõhnalävi
- 2.21 murdumisnäitaja
- 2,22 pH
- 2.23 Stabiilsus
- 2.24 Reaktsioonid
- 3 Kokkuvõte
- 4 Kasutamine
- 5 Riskid
- 6 Viited
Tsüklohekseeni struktuur
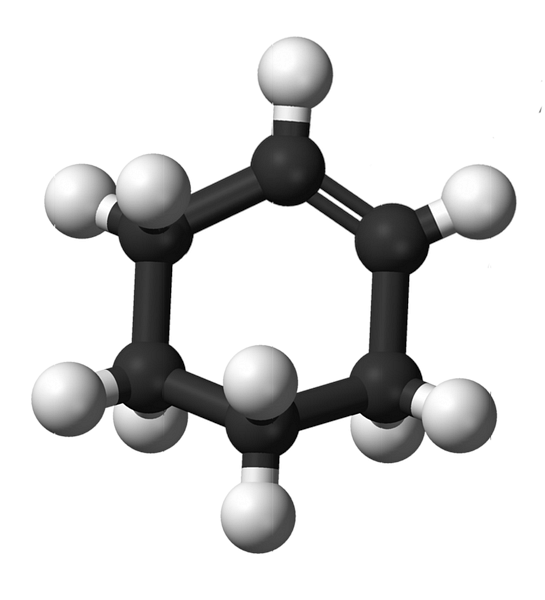
Tsüklohekseeni struktuur sfääride ja baaride mudeliga on näidatud ülaloleval pildil. Võib täheldada kuut süsiniktsüklit ja kaksiksidet, mõlemad ühendi küllastumata. Sellest vaatenurgast tundub, et rõngas on tasane; kuid see ei ole üldse.
Starterite puhul on kaksiksideme süsinikuaatomid sp-hübridiseerunud2, mis annab neile trigonaalse tasapinna geomeetria. Seetõttu on need kaks süsinikku ja nendega külgnevad küljed samas tasapinnas; samas kui kaks süsinikku vastaspoolel (kaksiksidemega) on nimetatud tasapinna kohal ja allpool.
Madalam pilt illustreerib täiesti seda, mida äsja selgitatud.

Pange tähele, et must riba koosneb neljast süsinikust: kaks kaksiksidet ja teised nendega külgnevad. Eksponeeritud perspektiiv on see, mis saadakse, kui pealtvaataja paigutaks oma silmad otse kaksiksideme ette. Seejärel võib näha, et süsinik on selle tasapinna kohal ja all.
Kuna tsüklohekseeni molekul ei ole staatiline, vahetavad kaks süsinikuaatomit: üks on madalam, samas kui teine tõuseb tasapinna kohal. Nii et te arvate, et see molekul käitub.
Intermolekulaarsed koostoimed
Tsüklohekseen on süsivesinik, mistõttu selle intermolekulaarsed interaktsioonid põhinevad Londoni dispersioonijõududel..
See on sellepärast, et molekul on apolaarne, ilma püsiva dipoolmomendita ja selle molekulmass on tegur, mis aitab kõige enam hoida vedelikus ühtekuuluvust..
Samuti suurendab topeltside interaktsiooni astet, kuna see ei saa liikuda sama paindlikult kui teiste süsinikuaatomite omaga ning see soodustab naabermolekulide vahelist koostoimet. Sel põhjusel on tsüklohekseenil veidi kõrgem keemistemperatuur (83 ° C) kui tsükloheksaan (81 ° C)..
Omadused
Keemilised nimetused
Tsüklohekseen, tetrahüdrobenseen.
Molekulmass
82,146 g / mol.
Füüsiline välimus
Värvitu vedelik.
Lõhn
Magus lõhn.
Keemistemperatuur
83 ° C kuni 760 mmHg.
Sulamistemperatuur
-103,5 ° C.
Süütepunkt
-7ºC (suletud tass).
Lahustuvus vees
Praktiliselt lahustumatu (213 mg / l).
Lahustuvus orgaanilistes lahustites
Seguneb etanooli, benseeni, süsiniktetrakloriidi, petrooleetri ja atsetooniga. Eeldatakse, et see suudab lahustada apolaarseid ühendeid, nagu mõned söe allotropid.
Tihedus
0,810 g / cm3 temperatuuril 20 ° C.
Auru tihedus
2.8 (võrreldes õhuga, mis on võrdne 1-ga).
Aururõhk
89 mmHg temperatuuril 25 ° C.
Isesüttimine
244 ° C.
Lagunemine
Laguneb uraanisoolade juuresolekul päikesevalguse ja ultraviolettkiirguse mõjul.
Viskoossus
0,625 mPascal 25 ° C juures.
Põlemise soojus
3,751,7 kJ / mol 25 ° C juures.
Aurustumistemperatuur
30,46 kJ / mol 25 ° C juures.
Pinna pinge
26,26 mN / m.
Polümerisatsioon
See võib teatud tingimustel polümeriseeruda.
Lõhnalävi
0,6 mg / m3.
Murdumisnäitaja
1,4465 temperatuuril 20 ° C.
pH
7-8 ° C juures.
Stabiilsus
Tsüklohekseen ei ole pikaajalise säilitamise ajal väga stabiilne. Valguse ja õhu kokkupuude võib põhjustada peroksiidide tootmist. Samuti ei sobi see tugevate oksüdeerivate ainetega.
Reaktsioonid
-Tsükloalkeenid kogevad peamiselt liitumisreaktsioone, nii elektrofiilseid kui ka vabu radikaale.
-Reageerib koos broomiga, moodustades 1,2-dibromotsükloheksaani.
-Oksüdeerub kaaliumpermanganaadi (KMnO) juuresolekul kiiresti4).
-See on võimeline tootma peroksübensoehappe juuresolekul epoksiidi (tsüklohekseeni oksiidi).
Süntees
Tsüklohekseen toodetakse tsükloheksanooli happekatalüüsiga:
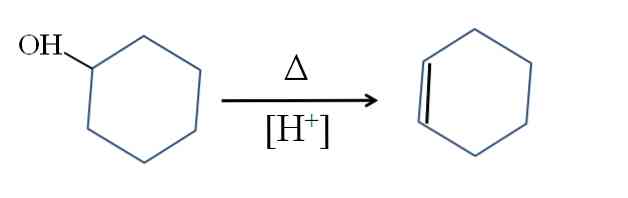
Sümbol A kujutab soojust, mis on vajalik, et soodustada OH rühma väljumist veemolekulina happelises keskkonnas (-OH2+).
Tsüklohekseeni toodetakse ka benseeni osalisel hüdrogeenimisel; see tähendab, et kaks selle kaksiksidet lisavad vesiniku molekuli:
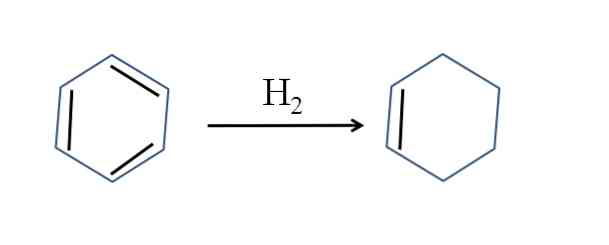
Kuigi reaktsioon tundub lihtne, nõuab see suurt rõhku H2 ja katalüsaatorid.
Kasutamine
-See on kasulik orgaanilise lahustina. Lisaks on see tooraine adipiinhappe, adipiin-aldehüüdi, maleiinhappe, tsükloheksaani ja tsükloheksüülkarboksüülhappe tootmiseks..
-Seda kasutatakse tsükloheksaankloriidi tootmiseks, mida kasutatakse vahendajana farmaatsiatoodete ja kummilisandite valmistamisel..
-Tsüklohekseeni kasutatakse ka tsükloheksanooni sünteesimiseks, ravimite, pestitsiidide, parfüümide ja värvainete tooraineks..
-Tsüklohekseen on seotud aminotsükloheksanooli sünteesiga, mida kasutatakse pindaktiivse ainena ja emulgaatorina..
-Lisaks võib butadieeni laboris valmistamiseks kasutada tsüklohekseeni. Viimati mainitud ühendit kasutatakse sünteetilise kautšuki valmistamiseks, rehvide valmistamiseks autodele ja seda kasutatakse ka akrüülplastide tootmisel..
-Tsüklohekseen on lüsiini, fenooli, polütsükloolefiinvaigu ja kummilisandite sünteesi tooraine.
-Seda kasutatakse kõrge oktaanarvuga bensiini stabilisaatorina.
-Kaasatud veekindlate kattekihtide, pragunemiskindlate kilede ja siduvate sideainete sünteesiga.
Riskid
Tsüklohekseen ei ole väga mürgine ühend, kuid võib põhjustada kokkupuutel naha ja silmade punetust. Selle sissehingamine võib põhjustada köha ja uimasust. Lisaks võib selle allaneelamine põhjustada uimasust, hingamisraskusi ja iiveldust.
Tsüklohekseen imendub seedetraktis halvasti, seega ei ole allaneelamise tõttu oodata tõsiseid süsteemseid toimeid. Suurim tüsistus on hingamisteede aspiratsioon, mis võib tekitada keemilist kopsupõletikku.
Viited
- Joseph F. Chiang ja Simon Harvey Bauer. (1968). Tsüklohekseeni molekulaarne struktuur. J. Am. Chem. Soc. 1969, 91, 8, 1898-1901.
- Karry Barnes. (2019). Tsüklohekseen: ohud, süntees ja struktuur. Uuring. Välja otsitud: study.com
- Morrison, R. T. ja Boyd, R. N. (1987). Orgaaniline keemia (5)ta Väljaanne.). Toimetus Addison-Wesley Iberoamericana.
- PubChem. (2019). Tsüklohekseen. Välja otsitud andmebaasist: pubchem.ncbi.nlm.nih.gov
- Keemiline raamat. (2019). Tsüklohekseen. Välja otsitud: chemicalbook.com
- Toksikoloogia andmevõrk. (2017). Tsüklohekseen. Võrk Välja otsitud: toxnet.nlm.nih.gov
- Chemoksü. (s.f.). Tsüklohekseeni struktuurivalem on. Välja otsitud andmebaasist: chemoxy.com


