Tubulina Alfa ja beeta, funktsioonid
The tubuliin on kahe polüpeptiidi moodustatud globulaarne dimeerne valk: alfa-tubuliin ja beeta. Need on korraldatud toru kujul, et tekitada mikrotuubulid, mis koos aktiinmikrofilamentidega ja vahefilamentidega moodustavad tsütoskeleti..
Mikrotuubuleid leidub mitmesugustes olulistes bioloogilistes struktuurides, nagu sperma lipukesed, siledate organismide laiendused, hingetoru ja pisutorud..
Lisaks sellele toimivad tubulinaid moodustavad struktuurid transpordiliinidena - rakkude sees olevate materjalide ja organellide rööbasteedega. Ainete ja struktuuride nihkumine on võimalik tänu mikrotuubulitega seotud mootori valkudele, mida nimetatakse kinesiiniks ja dyneiiniks..
Indeks
- 1 Üldised omadused
- 2 Tubuliini alfa ja beeta
- 3 Funktsioonid
- 3.1 Tsütoskelett
- 3.2 Mitoos
- 3.3 Centrosome
- 4 Evolutsiooniline perspektiiv
- 5 Viited
Üldised omadused
Tubuliini subühikud on 55 000 daltoni heterodimeerid, mis on mikrotuubulite ehituskivid. Tubuliini leidub kõigis eukarüootsetes organismides ja see on evolutsiooni käigus väga konserveerunud.
Dimeer koosneb kahest polüpeptiidist, mida nimetatakse tubuliin alfa ja beeta. Need polümeriseeritakse mikrotuubulite moodustamiseks, mis koosnevad kolmteist protofilamentist, mis on paigutatud paralleelselt õõnes toru kujul..
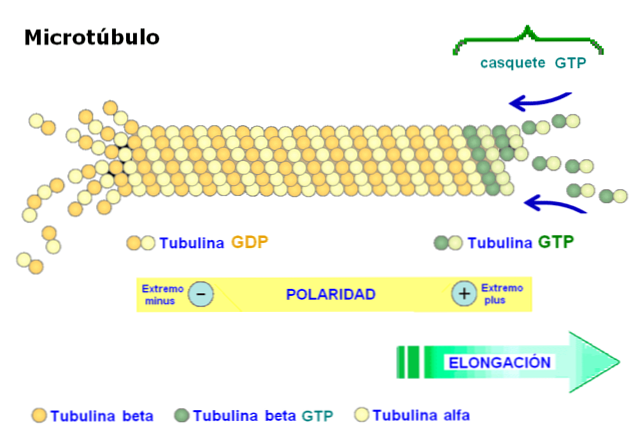
Üks mikrotuubulite olulisemaid omadusi on struktuuri polaarsus. Teisisõnu, mikrotuubuli kaks otsa ei ole ühesugused: ühte otsa nimetatakse kiiresti kasvavaks otsteks või "rohkem" ja teine ots aeglaseks või "vähemaks"..
Polaarsus on oluline, kuna see määrab liikumissuuna piki mikrotuubulit. Tubuliini dimeer on võimeline polümeriseeruma ja depolariseerima kiires kokkupanekutsüklis. See nähtus esineb ka aktiinfilamentides.
On olemas kolmandat tüüpi alaühik: see on gamma-tubuliin. See ei ole mikrotuubulite osa ja paikneb tsentrosoomides; siiski osaleb see mikrotuubulite tuumas ja moodustamises.
Tubuliini alfa ja beeta
Alfa- ja beeta-subühikud on tugevalt seotud kompleksse heterodimeeri moodustamisega. Tegelikult on kompleksi koostoime nii intensiivne, et see ei erine normaalsetes tingimustes.
Neid valke moodustavad 550 aminohapet, enamasti happed. Kuigi alfa- ja beeta-tubuliinid on üsna sarnased, kodeerivad need erinevad geenid.
Alfa tubuliinis leidub atsetüülrühmaga aminohappejääke, mis annavad raku lippellades erinevaid omadusi.
Iga tubuliini alamühik on seotud kahe molekuliga: alfa-tubuliinis seondub GTP pöördumatult ja ühendi hüdrolüüsi ei toimu, samas kui teine seondumiskoht tubuliin-beeta seondub pöörduvalt GTP-ga ja hüdrolüüsib selle.
GTP hüdrolüüs põhjustab fenomeni, mida nimetatakse "dünaamiliseks ebastabiilsuseks", kus mikrotuubulid läbivad kasvu- ja lagunemistsüklid, sõltuvalt tubuliinisõltuvuse kiirusest ja GTP hüdrolüüsi kiirusest..
See nähtus tähendab mikrotuubulite suurt liikumiskiirust, kus struktuuri poolväärtusaeg on vaid mõni minut.
Funktsioonid
Tsütoskelett
Tubuliini polümerisatsiooni alfa- ja beeta-subühikud, mis tekitavad tsütoskeleti osa mikrotuubulitest.
Lisaks mikrotuubulitele koosneb tsütoskelett kahest täiendavast struktuurielemendist: aktiini mikrofiltrid umbes 7 nm ja vahefilamentid läbimõõduga 10-15 nm..
Tsütoskelett on raku raamistik, see toetab ja säilitab raku vormi. Membraan ja subcellulaarsed sektsioonid ei ole aga staatilised ja on pidevas liikumises, et oleks võimalik teostada endotsütoosi, fagotsütoosi ja materjalide sekretsiooni nähtusi..
Tsütoskeleti struktuur võimaldab rakul end ise täita, et täita kõiki mainitud funktsioone.
See on ideaalne vahend rakuliste organellide, plasma membraani ja teiste rakuliste komponentide jaoks, et täita oma tavapäraseid funktsioone lisaks osalemisele rakkude jagunemisel.
Nad aitavad kaasa ka selliste rakkude liikumise nähtustele nagu amoebaside liikumine ja spetsiaalsed nihkumise struktuurid nagu ripsmed ja lipud. Lõpuks vastutab see lihaste liikumise eest.
Mitoos
Tänu dünaamilisele ebastabiilsusele saab mikrotuubuleid rakkude jagunemise protsesside käigus täielikult ümber korraldada. Mikrotuubulite paigutus liidese ajal on võimeline demonteerima ja tubuliini subühikud on vabad.
Tubuliin võib uuesti kokku panna ja pärineda mitootilisest spindlist, mis osaleb kromosoomide eraldamisel.
On teatud ravimeid, nagu kolhitsiin, taksool ja vinblastiin, mis katkestavad rakkude jagunemise protsessid. Toimib otse tubuliini molekulide suhtes, mis mõjutavad mikrotuubulite kokkupanekut ja dissotsiatsiooni.
Centrosome
Loomarakkudes ulatuvad mikrotuubulid tsentosoomi, mis on tuumiku lähedane struktuur, mille moodustavad paar sentriooli (kumbki on risti suunatud) ja ümbritsetud amorfse ainega, mida nimetatakse peritsentriolaarseks maatriksiks..
Tsentrioolid on silindrilised korpused, mis on moodustatud üheksast mikrotuubulite tripletist, organismis, mis on sarnane rakuliste rõngaste ja lipuga..
Rakkude jagunemise protsessis ulatuvad mikrotuubulid kesksoomidest, moodustades mitootilise spindli, mis vastutab kromosoomide õige jaotumise eest uutele tütarrakkudele..
Tundub, et tsentrioolid ei ole rakkude sees mikrotuubulite kogumiseks hädavajalikud, kuna nad ei ole taimerakkudes või mõnes eukarüootses rakus, nagu teatud näriliste ovulites.
Peritsentriolaarse maatriksi puhul toimub initsiatsioon mikrotuubulite kokkupanekuks, kus tuuma tekib gamma-tubuliini abil..
Evolutsiooniline perspektiiv
Kolm tüüpi tubuliini (alfa, beeta ja gamma) kodeerivad erinevad geenid ja on homoloogsed geeniga, mis on leitud prokarüootides, mis kodeerivad 40 000 daltoni valku, nimega FtsZ. Bakteriaalne valk on funktsionaalselt ja struktuurilt sarnane tubuliiniga.
On tõenäoline, et valgul oli bakterites esivanem funktsioon ja seda modifitseeriti evolutsiooniprotsesside käigus, lõpetades valgu funktsioonidega, mida ta mängib eukarüootides..
Viited
- Cardinali, D. P. (2007). Rakendatud neuroteadus: selle alused. Ed. Panamericana Medical.
- Cooper, G.M. (2000). Cell: Molekulaarne lähenemine. 2. väljaanne. Sunderland (MA): Sinauer Associates.
- Curtis, H., & Schnek, A. (2006). Kutse bioloogiasse. Ed. Panamericana Medical.
- Frixione, E., & Meza, I. (2017). Living machines: Kuidas rakud liiguvad?. Majanduskultuuri Fond.
- Lodish H, Berk A, Zipursky SL, et al. (2000). Molekulaarrakkude bioloogia. 4. väljaanne. New York: W. H. Freeman.


