Ziehl-Neelsen Stain Foundation, reaktiivid ja tehnika
The Ziehl-Neelseni värvimine värvimismeetodil alkohol-happekindlate mikroorganismide (AAR) identifitseerimiseks. Selle mikrobioloogia protseduuri nimi viitab selle autoritele: bakterioloog Franz Ziehl ja patoloog Friedrich Neelsen.
See meetod on diferentseeritud värvi tüüp, mis eeldab erinevate värvide kasutamist, et luua kontrast nende struktuuride vahel, mida soovite jälgida, diferentseerida ja hiljem identifitseerida. Ziehl-Neelseni peitsit kasutatakse teatud tüüpi mikroorganismide tuvastamiseks.
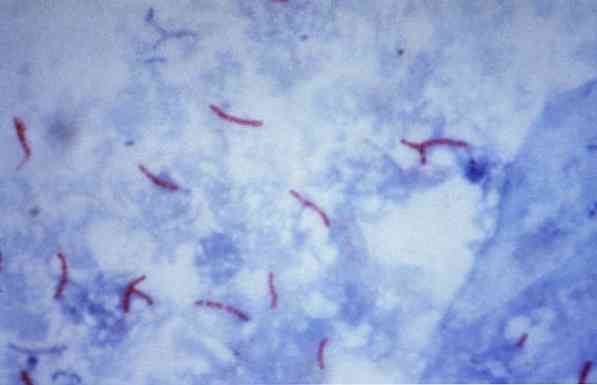
Mõned neist mikroorganismidest on mükobakterid (näiteks, Mycobacterium tuberculosis), nocardias (näiteks, Nocardia sp.) ja mõned ühikulised parasiidid (näiteks, Cryptosporidium parvum). Paljusid baktereid võib klassifitseerida tavalise tehnika abil, mida nimetatakse Grami plekiks.
Kuid mõned bakterirühmad vajavad nende identifitseerimiseks muid meetodeid. Sellised meetodid nagu Ziehl-Neelsen värvimine nõuavad värvainete kombinatsiooni soojusega, et kinnitada esimene raku seinale.
Seejärel tekib värvimuutus, mis võimaldab kahte tulemust: resistentsust või tundlikkust värvuse muutumise suhtes hapete ja alkoholidega.
Indeks
- 1 Sihtasutus
- 1.1 Sekundaarne värvimine
- 2 reaktiivi
- 2.1 Esmane värvimine
- 2.2 Värvitustav lahendus
- 2.3 Teisene värvimine (värvivastane aine)
- 3 Tehnika
- 3.1 Happega kiire värvimise protseduur
- 4 Viited
Sihtasutus
Selle värvimistehnika aluseks on nende mikroorganismide rakuseina omadused. Seina moodustavad mütsoolhappeid nimetavad rasvhapped; Neid iseloomustab väga pikk ahel.
Kui rasvhapetel on väga pikad struktuurid, võivad nad värve kergemini säilitada. Mõnede bakterite perekondade rakkude seina kõrge mükoolhappe sisalduse tõttu on Grami värviga väga raske värvida.
Ziehl-Neelseni värvides kasutatakse fenoolühendi karboolfuksiini, põhivärvi. See on võime interakteeruda rakuseina rasvhapetega, mis on toatemperatuuril vahajas tekstuur.
Karbooli fuchsiini värvimist parandatakse soojuse juuresolekul, sest vaha sulab ja värvimolekulid liiguvad kiiremini rakuseinasse.
Hiljem kasutatav hape aitab värvida rakke, mis ei olnud värvunud, sest nende sein ei olnud piisavalt värvainega seotud; seetõttu on happevärvi vähendaja võimeline eemaldama happevärvi. Sellele värvimuutusele vastupidavaid rakke nimetatakse happekindlateks.
Sekundaarne värvimine
Pärast proovi värvimuutust on see vastuolus teise värviga, mida nimetatakse sekundaarseks värviks. Tavaliselt kasutatakse metüleensinist või malahhiid rohelist.
Sekundaarne värv määrab taustmaterjali ja seeläbi tekitab kontraste esimeses etapis värvitud struktuuridele. Ainult värvunud rakud neelavad teist värvi (anti-peits) ja võtavad nende värvi, samas kui happekindlad rakud säilitavad punase värvi.
Seda protseduuri kasutatakse sageli Mycobacterium tuberculosis ja Mycobacterium leprae, mida nimetatakse happega kiireks batsilliks.
Reaktiivid
Esmane värvimine
Kasutatakse 0,3% karboksiini fukssiini (filtreeritud). See värv on valmistatud alkoholidest: fenoolist etanoolis (90%) või metanoolis (95%) ja selles segus lahustatakse 3 grammi aluselist fuksiini..
Värvitustav lahendus
Selles etapis saab kasutada 3% alkoholi happe või 25% väävelhappe lahuseid.
Sekundaarne värvimine (anti-värvaine)
Proovide kontrastsuse teostamiseks kõige sagedamini kasutatav värv on tavaliselt 0,3% metüleensinine. Kasutada võib ka teisi, näiteks 0,5% malahhiitrohelist.
Tehnika
Happega kiire värvimise protseduur
Valmistage ette bakteriaalne määrdeain
See preparaat on valmistatud puhta ja kuiva slaidi abil, järgides steriilsuse ettevaatusabinõusid.
Määrdeaine kuivatamine
Laske määrdel kuivada toatemperatuuril.
Proovi kuumutatakse
Proovi tuleb kuumutada allpool olevale slaidile. Alkoholiga saab fikseerida siis, kui määret ei ole röga abil töödeldud (seda valgendatakse naatriumhüpokloritiga) ja kui seda ei värvi kohe..
M. tuberculosis See elimineeritakse valgendi ja värvimisprotsessi ajal. Töötlemata röga termofunktsioon ei tapa M. tuberculosis, arvestades, et fikseerimine alkoholiga on bakteritsiidne.
Katke plekk
Värv on kaetud karboolfuksiini lahusega (primaarne põhiline plekk).
Kuumutage plekki
Seda tehakse 5 minutit. Pange tähele, et aur vabaneb (umbes 60 ° C). Oluline on mitte üle kuumeneda ja vältida proovi põletamist.
Seemne kuumutamisel tuleb fuchsiini karbooli kuumutamisel olla eriti ettevaatlik, eriti kui värvimine toimub plaadil või muul mahutil, kus eelmisest värvimisest on kogutud väga tuleohtlikke kemikaale..
Slaidide all tuleb kasutada ainult väikest leeki, kasutades eelnevalt mõne tilga happe alkoholi, metanooli või 70% etanooli niisutatud valgustatud tampooni. Vältige suure etanooliga niisutatud tampooni kasutamist, sest see on tuleoht.
Peske peits
See pesemine peaks toimuma puhta veega. Kui kraanivesi ei ole puhas, peske määrdeainet filtreeritud või destilleeritud veega, eelistatavalt.
Katke määrdeainega happeline alkohol
See happe alkohol peaks olema 3%. Katvus viiakse läbi 5 minuti jooksul või kuni määrdumine on piisavalt värvunud, st kahvaturoosa.
Tuleb arvestada, et happe alkohol on tuleohtlik; seetõttu tuleb seda kasutada väga hoolikalt. Vältige süüteallikate lähedust.
Peske peits
Pesemine peaks toimuma puhta destilleeritud veega.
Katke määrdeaine värviga
See võib olla roheline malahhiit (0,5%) või metüleensinine (0,3%) värvainet 1 või 2 minuti jooksul, kasutades kõige pikemat aega, kui määrdumine on õhuke.
Peske peits
Puhast vett tuleb uuesti kasutada (destilleeritud).
Drain
Slaidi tagakülg tuleb puhastada ja plekk asetada drenaaži riiulile, et see oleks õhu käes kuivatatud (ärge kasutage kuivatamiseks absorbeerivat paberit)..
Uurige mikroskoobi määrdumist
Kasutada tuleks 100X eesmärki ja kastmisõli. Skaneerige määrdeainet süstemaatiliselt ja kirjutage asjakohased tähelepanekud.
Tulemuste tõlgendamine
Teoreetiliselt peetakse punakasvärviga värvitud mikroorganisme happega kiireks positiivseks (AAR +).
Vastupidi, kui mikroorganismid on värvitud sinine või roheline, sõltuvalt värvainest, mida kasutatakse värvainena, peetakse neid negatiivseks alkoholile resistentseks happeks (AAR-).
Viited
- Apurba, S. & Sandhya, B. (2016). Praktilise mikrobioloogia alused (1. väljaanne). Jaypee Brothers Medical Publishers.
- Bauman, R. (2014). Mikrobioloogia koos haigustega kehasüsteemi poolt (4. trükk). Pearson Education, Inc.
- Heritage, J., Evans, E. & Killington, A. (1996). Sissejuhatav mikrobioloogia (1. väljaanne). Cambridge'i ülikooli press.
- Morello, J., Granato, P. Wilson, M. & Morton, V. (2006). Laboratoorne käsiraamat ja mikrobioloogia töövihik: patsiendihoolduse rakendused (11. väljaanne). McGraw-Hill'i haridus.
- Vasanthakumari, R. (2007). Mikrobioloogia õpik (1. väljaanne). B.I. Publikatsioonid PVT.


