Giemsa värvimise alus, materjalid, tehnika ja kasutusalad
The Giemsa plekk on kliiniliste proovide värvimise tüüp, mis põhineb happeliste ja aluseliste värvainete segul. Selle loomist inspireeris Romanowsky töö, kus Saksamaalt pärit keemik ja bakterioloog Gustav Giemsa täiustas seda, lisades ühendite stabiliseerimiseks glütserooli..
Romanowski originaalsele tehnikale tekkinud muutused võimaldasid oluliselt parandada mikroskoopilisi vaatlusi, seega ristiti tehnikat Giemsa värviga.
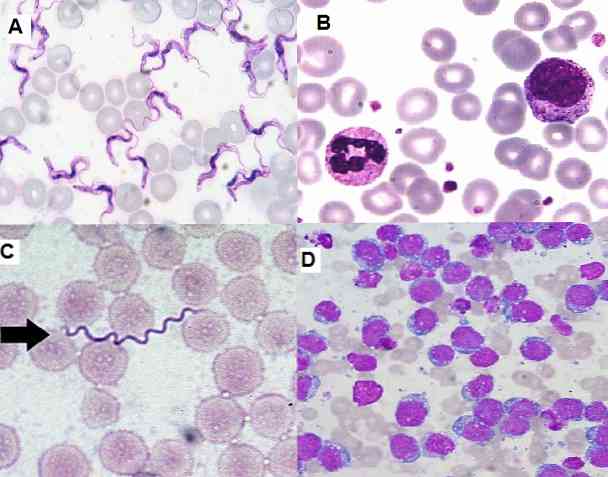
Kuna tegemist on lihtsa tehnikaga, mis on väga funktsionaalne ja ökonoomne, kasutatakse seda kliinilises laboris laialdaselt hematoloogiliste määrete, luuüdi proovide ja koeosade jaoks..
Giemsa värvimistehnika on väga kasulik tsütoloogilistes uuringutes, kuna see võimaldab jälgida rakkude spetsiifilisi struktuure. See meetod värvib rakkude tsütoplasmid, tuumad, nukleiinid, vakuoolid ja graanulid, et oleks võimalik eristada isegi peeneid kromatiini jälgi.
Lisaks on võimalik tuvastada tuuma suuruse, kuju või värvuse olulisi muutusi, kus on võimalik visualiseerida tuuma-tsütoplasma suhte kadu..
Teisest küljest võimaldab see tuvastada luuüdis ja perifeerses veres ebaküpseid rakke, mis on olulised tõsiste haiguste, näiteks leukeemia diagnoosimiseks. Samuti on võimalik avastada ka hemoparasiite, ekstra- ja intratsellulaarseid baktereid, seeni.
Tsütogeneetikas kasutatakse seda üsna hästi, sest rakkude mitoosi on võimalik uurida.
Indeks
- 1 Giemsa värvi loomine
- 2 Materjalid
- 2.1 Materjalid emalahuse valmistamiseks
- 2.2 Emalahuse valmistamisviis
- 2.3 Materjalid puhverlahuse valmistamiseks
- 2.4 Värvaine lõplik valmistamine
- 2.5 Värvimiseks vajalikud lisamaterjalid
- 3 Tehnika
- 3.1 Värvimisprotsess
- 4 Utiliidid
- 4.1 Hematoloogia
- 4.2 Mükoloogia
- 4.3 Bakterioloogia
- 4.4 Parasiitoloogia
- 4.5 Tsütoloogia
- 4.6 Tsütogeneetika
- 5 Giemsa värvimise tõhusust tõendav uuring
- 6 Soovitused hea värvimise kohta
- 7 Giemsa värvimisel esinevad üldised vead
- 7.1 Eriti sinine värv
- 7.2 Liiga roosa värv
- 7.3 Sadestumise esinemine määrdeaines
- 7.4 Morfoloogiliste esemete olemasolu
- 8 Salvestusrežiim
- 9 Viited
Giemsa värvi loomine
Romanowski tüüpi värvained põhinevad happe ja aluseliste värvainete vahelise kontrastsuse kasutamisel, et saavutada põhi- ja happestruktuuride värvimine. Nagu näha, on happevärvainete afiinsus põhistruktuuride värvimiseks ja vastupidi.
Kasutatav põhivärv on metüleensinine ja selle oksüdeeritud derivaadid (Azure A ja Azure B), samas kui happevärv on eosiin..
Rakkude happelised struktuurid on muu hulgas nukleiinhapped, segmenteeritud basofiilide graanulid, seetõttu värvitakse nad metüleensinise värviga.
Sama tähenduses on rakkude põhistruktuurid hemoglobiin ja mõned graanulid, näiteks need, mis sisalduvad segmenteeritud eosinofiilides; need värvitakse eosiiniga.
Teisest küljest, kuna metüleensinine ja taevas on metakromaatsete värvidega iseloomulikud, võivad nad anda erinevatele struktuuridele varieeruva tooni vastavalt nende valduses olevatele polüanioonide koormusele..
Nii on põhi-ja happevärvide strateegiline kombinatsioon võimeline välja töötama laia spektri värve vastavalt iga struktuuri biokeemilistele omadustele, kõndides läbi helesinise, tumeda sinise, lilla ja lilla toonide happeliste struktuuride puhul..
Kuigi eosiini pakutav värvus on stabiilsem, tekitades värve punakasoranži ja lõhe vahel.
Materjalid
Materjalid emalahuse valmistamiseks
Varulahuse valmistamiseks on vaja kaaluda 600 mg pulbristatud Giemsa värvainet, mõõtes 500 cm3 atsetoonivaba metüülalkoholi ja 50 cm3 neutraalset glütseriini..
Emalahuse valmistamisviis
Asetage raske Giemsa pulber uhmrisse. Kui on tükke, tuleb neid pihustada. Seejärel lisage märgatav kogus mõõdetud glütseriini ja segage väga hästi. Saadud segu valatakse väga puhtasse kollasesse pudelisse.
Ülejäänud glütseriin asetatakse uhmrisse. Segage uuesti, et puhastada mördi seintele jäänud värvainet ja valada samasse pudelisse.
Pudel kaetakse ja viiakse 2 tundi veevannis temperatuuril 55 ° C. Bain-marie vannis segage segu kergelt iga poole tunni tagant.
Seejärel lastakse segul jahtuda, et alkoholi panna. Varem paigutati osa mõõdetud alkoholist uhmrisse, et lõpetada värvaine jäänud pesemine, ja seejärel lisatakse see segule koos ülejäänud alkoholiga..
Sellel preparaadil peaks olema lubatud vähemalt 2 nädalat. Emalahuse osa tuleb filtreerida.
Et vältida preparaadi saastumist, on soovitav läbida osa, mis on pidevalt kasutatav tilgutiga väikese merevaikkollase pudeli juures. Laadige iga kord, kui reaktiiv lõpeb.
Puhverlahuse valmistamise materjalid
Teisest küljest valmistatakse puhverlahus pH 7,2 juures järgmiselt:
Kaalutakse 6,77 g (veevaba) naatriumfosfaati (NaHPO4), 2,59 g kaaliumdivesinikfosfaati (KH)2PO4) ja destilleeritud veega kuni 1000 cm3.
Värvaine lõplik valmistamine
Lõpliku värvimislahuse valmistamiseks mõõdetakse 2 cm3 filtreeritud põhilahust ja segatakse 6 cm3 puhverlahusega. Segu segatakse.
Asjakohane asjaolu, mida tuleb arvesse võtta, on see, et värvi valmistamise meetodid võivad kaubandusmaja järgi muutuda.
Värvimiseks vajalikud lisamaterjalid
Lisaks kirjeldatud materjalidele peaks olema varustatud värviliste sildade, veekraanide või pesupuhvriga, esemete või kaantega lehtedega, stopperiga, et kontrollida värvusajaid, ja paberit või mõnda materjali, mida saab kasutada kuivamiseks ( marli või puuvilla).
Tehnika
Värvimisprotsess
1) Enne värvimist peate proovi levima puhtale slaidile..
Proovideks võivad olla veri, luuüdi, histoloogiliste kudede tükid või emakakaelavälised proovid. Soovitatav on, et välispidised oleksid õhukesed ja enne värvimist värvitud 1 või 2 tundi.
2) Kõik lehed, mida pead värvima, asetatakse värvilisele sillale. Töötage alati ühes järjekorras ja identifitseerige iga leht hästi.
3) Asetage paar tilka 100% metüülalkoholi (metanool) määrdeainele ja jäetakse 3 kuni 5 minutiks proovile, et proovi fikseerida ja kuivatada..
4) Visake lehel olev metanool ära ja laske õhul kuivada.
5) Pärast kuivatamist asetage lõplik värvimislahus tilgutiga, kuni kogu leht on kaetud. Jätke 15 minutiks seisma. Mõned autorid soovitavad kuni 25 minutit. Sõltub kommertsmajast.
6) Tühjendage värvainet ja peske määret destilleeritud veega või 7,2 puhverlahusega.
7) Blotpaberil laske lehtedel vabas õhus kuivada, paigutatud tugi abil vertikaalselt.
8) Pühkige slaidi tagakülge alkoholiga niisutatud marli või vatitampooniga, et eemaldada järelejäänud värv.
Utiliidid
Giemsa värvimistehnikat kasutatakse mitmes valdkonnas, sealhulgas: hematoloogia, mükoloogia, bakterioloogia, parasitoloogia, tsütoloogia ja tsütogeneetika.
Hematoloogia
See on selle värvimise kõige sagedasem kasulikkus. Selle abil saame tuvastada iga luuüdi või perifeerse vere proovides olevad rakud. Lisaks iga seeria hindamisele on võimalik leukotsütoosi või leukopeenia, trombotsütopeenia jne avastamine..
Kuna see on tundlik ebaküpsete rakkude tuvastamiseks, on see oluline akuutsete või krooniliste leukeemiate diagnoosimisel. Samuti on võimalik diagnoosida ka aneemia, nagu sirprakuline haigus, sirprakuline haigus..
Mükoloogia
Selles valdkonnas on tavaline, et seda otsida Histoplasma capsulatum (intratsellulaarne dimorfne seen) koeproovides.
Bakterioloogia
Giemsa värvitud hematoloogilistel määrdudel on võimalik avastada Borrelias sp patsientidel, kellel haigust nimetatakse palavikuks. Kuumuste tippude juures võetud proovides on spirokeetid rohkesti erütrotsüütide hulgas.
Samuti on võimalik visualiseerida rakusiseseid baktereid Rickettsias sp ja Chlamydia trachomatis nakatunud rakkudes.
Parasiitoloogia
Parasiitoloogia valdkonnas on Giemsa värvimine võimaldanud diagnoosida parasiithaigusi nagu malaaria, Chagase tõbi ja leishmaniasis..
Esimesel kahel parasiidil Plasmodium sp ja Trypanosoma cruzi neid saab visualiseerida nakatunud patsientide perifeerses veres, neid võib leida erinevates etappides vastavalt haiguse faasile..
Vere parasiitide otsimise parandamiseks on soovitatav kasutada Giemsa plekki, mis on segatud May-Grünwaldi värviga.
Samamoodi saab diagnoosida naha biopsiate proovide hindamisel nahalähedase leishmaniaasi, kus parasiit leiti.
Tsütoloogia
Giemsa värvimist kasutatakse ka endotservikaalsete proovide tsütoloogiliseks uuringuks, kuigi see ei ole selleks kõige sagedamini kasutatav tehnika..
Kuid ressursside nappuse korral võib kasutada funktsioone, mis on sarnased Papanicolaou tehnikaga pakutavate omadustega ja madalama hinnaga. Siiski vajab see eksamineerija eksperditeadmisi.
Tsütogeneetika
Giemsa värvimise oluline tunnusjoon on selle võime seonduda tugevalt DNA adeniinide ja tümiinidega rikaste piirkondadega. See võimaldab DNA-d visualiseerida rakkude mitoosi ajal, erinevates kondensatsioonitingimustes.
Need uuringud on vajalikud kromaatiliste aberratsioonide, näiteks kromosoomide erinevate piirkondade dubleerimise, deletsioonide või translokatsioonide tuvastamiseks..
Giemsa värvimise tõhusust tõendav uuring
Cannova jt (2016) võrdlesid 3 värvimistehnikat naha leishmaniasise diagnoosimiseks.
Selleks kasutasid nad katseloomadest saadud proove (Mesocrisetus auratus) eksperimentaalselt inokuleeritud Leishmaniasega.
Autorid näitasid, et Giemsa värvimine oli parem kui Pap-mart® ja Gaffney värvimine. Seetõttu leidsid nad, et Giemsa plekk on ideaalne naha leishmaniasise diagnoosimiseks.
Autorite suurepärased tulemused on tingitud asjaolust, et Giemsa segu moodustavate värvainete kombinatsioon annab vajalikud tingimused soodsa kontrasti loomiseks, võimaldades selgelt eristada amastigootstruktuure, nii intra- kui ka ekstratsellulaarselt..
Teised meetodid (Pap-mart® ja Gaffney) tegid seda ka, kuid nõrgemal viisil ja seetõttu raskemini visualiseerida. Seetõttu soovitatakse Giemsa plekk leishmaniasise parasiitoloogiliseks diagnoosimiseks.
Samamoodi hinnati Ramírez et al. (1994) uuringus Giemsa ja Lendrum'i plekkide kehtivust konjunktivaalsetes määretes, et tuvastada Chlamydia trachomatis.
Autorid leidsid, et Giemsa ja Ledrum värvimisel on sama spetsiifilisus, kuid Giemsa oli tundlikum.
See selgitab, miks on praegu Glamsa värvimine klamüüdiainfektsioonide diagnoosimisel kõige sagedamini kasutatav, eriti kui on vähe ressursse.
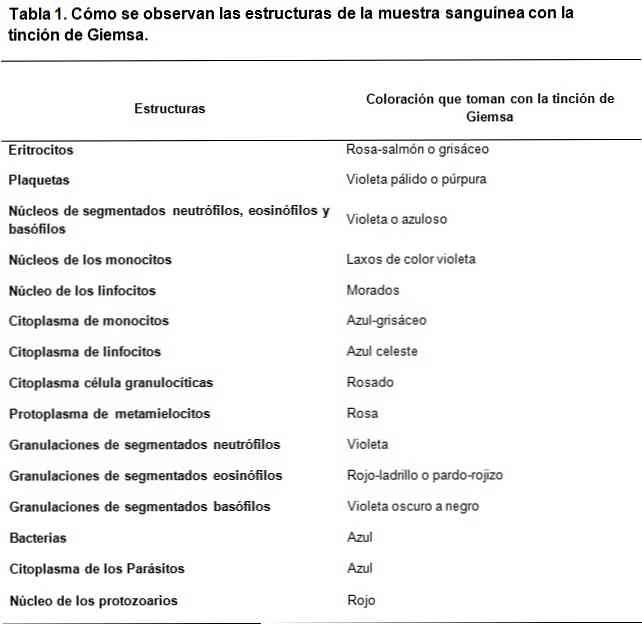
Soovitused hea värvimise kohta
Lehtede kuivatamist ei tohiks kiirendada. Vabaõhu kuivatamiseks tuleb oodata usaldatavusnõudeid. Umbes 2 tundi.
Parimate tulemuste saavutamiseks värvi kohe pärast 2 tundi.
Selleks, et määrdeained oleks paremini fikseeritud ja värvitud, tuleb proov jaotada lehele nii, et jääb õhuke ja ühtlane kiht..
Eelistatud vereproov on kapillaar, kuna määret tehakse otse verepilti ja seetõttu ei ole proovil lisandit, mis soodustab rakustruktuuride säilitamist..
Kui aga kasutatakse venoosset verd, tuleb EDTA-d kasutada antikoagulandina, mitte hepariinina, kuna viimane deformeerib rakud tavaliselt.
Üldised vead Giemsa värvimisel
Selle värvimise praktikas võib teha vigu. Neid tõendab struktuuride varjundite järsk muutus.
Äärmiselt sinine värv
Selle põhjuseks võib olla:
- Väga paksud määrdumised
- Värvimisaja ületamine
- Liiga vähe pesu.
- Reagentide kasutamine neutraalsest pH tasemest kõrgemal (leeliseline).
Nendel tingimustel moonutatakse järgmiste struktuuride värve, nii et erütrotsüüdid surevad roosa-lõhe asemel rohelised, eosinofiilide graanulid, mis peaksid olema värvitud punase telliskiviga, muutuvad siniseks või halliks ja nii edasi kõrvalekalle tavapärastes toonides.
Liiga roosa värvus
Selle põhjuseks võib olla:
- Piisav värvimisaeg.
- Pikaajaline või liigne pesemine.
- Halb kuivamine.
- Väga happeliste reagentide kasutamine.
Sel konkreetsel juhul ei ole tavaliselt värvitud sinised struktuurid peaaegu nähtavad, samas kui värvitud roosad on väga liialdatud..
Näide: erütrotsüüdid võtavad erkpunase või tugeva oranži värvi, tuumakromatiin näeb kahvaturoosa ja eosinofiilide graanulid muutuvad helepunaks..
Sadestumise esinemine määrdeaines
Põhjused võivad olla:
- Kasutage määrdunud või halvasti pestud plaate.
- Ärge laske määrdel kuivada.
- Jätke kinnituslahus liiga kaua.
- Ebapiisav pesemine värvimise lõpus.
- Kasutatava värvi ebapiisav filtreerimine või filtrimata jätmine.
Morfoloogiliste esemete olemasolu
Mustadel võib esineda morfoloogilisi esemeid, mis raskendavad olemasolevate struktuuride visualiseerimist ja tõlgendamist. Selle põhjuseks on:
- Kasutatud antikoagulandi tüüp, näiteks hepariin.
- Määrdunud, kahjustatud või rasvaste lehtede kasutamine.
Salvestusrežiim
Pärast valmistamist tuleb värvainet hoida toatemperatuuril (15–25 ° C), et vältida värvaine sadestumist. Seda tuleb hoida suletud merevaigukarpis.
Viited
- Cannova D, Brito E ja Simons M. Värvimistehnikate hindamine naha leishmaniasise diagnoosimiseks. Salus. 2016; 20 (2): 24-29.
- PanReac Applichem ITW reaktiivid. Giemsa plekk. Versioon 2: JMBJUL17 CEIVD10ES. Castellar del Vallés, Hispaania.
- Clark G. Värvimisprotseduurid (1981), 4th. Williams ja Willkins.
- Rakenduslik kliiniline keemia Giemsa värvaine diagnoosimiseks in vitro. Edasimüüja: cromakit.es
- Ramírez I, Mejía M, García de la Riva J, Hermes F ja Grazioso C. Giemsa ja Lendrum'i plekkide kehtivus konjunktivaalsetes määrdudes Chlamydia trachomatis. Bol of Sanit Panam. 1994; 116 (3): 212-216.
- Casas-Rincon G. Üldine mükoloogia. 1994. 2nd Ed. Universidad Central de Venezuela, raamatukogu väljaanded. Venezuela, Caracas.
- "Giemsa plekk." Wikipedia, vaba entsüklopeedia. 1 september 2017, 01:02 UTC. 6. detsember 2018, en.wikipedia.org.


