Agari vere sihtasutus, kasutamine ja ettevalmistamine
The vere agar see on rikastatud keskkond, diferentsiaal, kuid mitte selektiivne. Seda kasutatakse paljude mikroorganismide taastamiseks ja kasvuks kliinilistest proovidest või subkultuuridest.
Enamiku laborisse vastuvõetud kliiniliste proovide külvamiseks tuleks lisada klassikaline vere agar; välja arvatud väljaheite proovid, kui see ei ole kasulik, välja arvatud juhul, kui see on valmistatud teatud muudatustega.
See kultiveerimissööt koosneb põhiliselt rikastatud alusagarist ja 5% verest. Agari alus võib varieeruda vastavalt vajadusele, kuid peamiselt koosneb peptoonidest, aminohapetest, vitamiinidest, lihaekstraktist, naatriumkloriidist, agarist..
Mis puudutab verd, siis on tavaliselt vaja, et ta puutuks kokku bioteriumiga, et saada verd loomadelt, nagu lambad, küülikud või hobused. Siiski ei ole see alati võimalik ja mõnikord kasutatakse inimese verd.
Vere agarikeskkonda saab valmistada laboris või seda saab osta selleks mõeldud ettevõtetele. Selle söötme valmistamine on üks õrnamaid, mis tahes hooletus selle valmistamisel toob kaasa saastunud partii.
Sellepärast tuleb võtta kõik võimalikud ettevaatusabinõud ja lõpuks tuleb kvaliteedikontroll läbi viia inkubeerides 37 ° C juures 1 plaat iga 100 valmistatava plaadi kohta..
Indeks
- 1 Sihtasutus
- 2 Kasutamine
- 2.1 Veregrupi valik
- 2.2 Alusagari tüübi valik
- 2.3 Vere agari kasutamine vastavalt selle valmistamiseks kasutatavale alusele
- 3 Valmistamine
- 3.1 Kaaluge ja lahustage
- 3.2 Steriliseerida
- 3.3 Vere koondumine
- 3.4 Valage Petri tassidesse
- 4 Viited
Sihtasutus
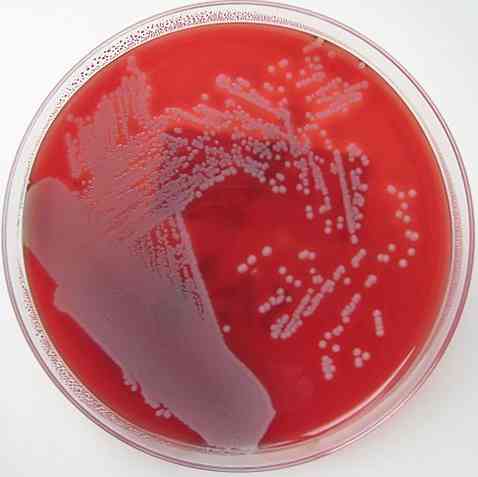 On juba mainitud, et vere agaril on omadus olla rikastatud, diferentsiaalne ja mitteselektiivne keskkond. Kõigi nende omaduste keldrit selgitatakse allpool.
On juba mainitud, et vere agaril on omadus olla rikastatud, diferentsiaalne ja mitteselektiivne keskkond. Kõigi nende omaduste keldrit selgitatakse allpool.
Veriagar on rikastatud söötme, kuna selle peamine lisaaine on agarialusel 5-10% verd. Mõlemad ühendid sisaldavad palju toitaineid ja see omadus võimaldab enamikul kultiveeritavatest bakteritest selles kasvada.
See kasv toimub piiranguteta; sel põhjusel ei ole see valikuline. Kuid kui sellesse söötmesse lisatakse ühendeid, mis takistavad mõnede mikroorganismide kasvu ja soodustavad teiste kasvamist, muutub see selektiivseks. See on nii, kui lisatakse teatud tüüpi antibiootikume või seenevastaseid aineid.
Samamoodi on vere agar diferentsiaal, kuna see võimaldab eristada kolme tüüpi baktereid: beeta-hemolüütilist, alfa-hemolüütilist ja gamma-hemolüütilist..
Beeta-hemolüütikud on need, mis suudavad lüüsida või täielikult murda punaseid vereliblesid, moodustades kolooniate ümber selge halo, tekitades seega ß või β hemolüüsi - hemolüüs ja mikroorganismid nimetatakse ß-hemolüütiliseks.
Ss-hemolüütiliste bakterite näited on Streptococcus pyogenes ja Streptococcus agalactiae.
Alfa-hemolüütikud on need, mis teostavad osalist hemolüüsi, kus hemoglobiin oksüdeerub metemoglobiiniks, tekitades kolooniate ümber rohekat värvi. See nähtus on tuntud kui hemolüüs α või α-hemolüüs ja bakterid on klassifitseeritud a-hemolüütilisteks..
Α-hemolüütiliste bakterite näide on Streptococcus pneumoniae ja Streptococcus rühmast viridans.
Lõpuks on olemas bakterid, mida nimetatakse gamma-hemolüütiliseks või mitte-hemolüütiliseks. Need kasvavad agaril ilma selleta muutusi tekitamata, γ-hemolüüsiks tuntud toime ja mikroorganismid on y-hemolüütilised.
Y-hemolüütiliste bakterite näide: mõned D-rühma Streptococcus tüved (Streptococcus bovis ja Enterococcus faecalis).
Kasutamine
Vere agar-kultiveerimiskeskkond on üks kõige sagedamini kasutatavaid mikrobioloogia laboris.
Mikroorganismide hulgast, mis on võimelised kasvama vere agarikeskkonnas, on ranged, fakultatiivsed, mikroaerofiilsed, anaeroobsed, grampositiivsed või gramnegatiivsed aeroobsed bakterid, kiiresti kasvavad või aeglaselt kasvavad bakterid.
Samuti kasvavad mõned toitumisest seisukohast nõudlikud või häirivad bakterid, samuti seened ja pärmid. Samuti on kasulik subkultuurida või taasaktiveerida tüvesid, mis on metaboolselt väga nõrgad.
Kuid veregrupi ja aluse agari valik varieerub sõltuvalt eeldatavast mikroorganismist, mida kahtlustatakse taaskasutamisel, ja plaadi (kultuuri või antibiootikumi) kasutamisest..
Veregrupi valik
Veri võib olla lambaliha, küülik, hobune või inimene.
Kõige soovitatavam on lambavere, mõningate eranditega. Näiteks selleks, et isoleerida Haemophilus'e liike, kus soovitatav veri on hobune või küülik, sest lambavere veres on ensüüme, mis inhibeerivad faktorit V.
Kõige vähem soovitatav on inimene, kuid see on kõige kasutatavam, võib-olla seetõttu, et see on kõige lihtsam saada.
Veri peab olema defibrineeritud, saadud ilma igasuguse lisaaine ja tervete loomadeta. Inimveri kasutamiseks tuleb meeles pidada mitmeid tegureid:
Kui veri pärineb bakteriaalseid infektsioone põdevatelt isikutelt, on neil spetsiifilised antikehad. Nendes tingimustes on tõenäoline, et mõnede bakterite kasvu inhibeeritakse.
Kui see on saadud verepangast, sisaldab see tsitraati ja on võimalik, et teatud bakterid ei teki oma juuresolekul. Teisest küljest, kui veri pärineb antibiootikume kasutavatelt patsientidelt, võib tundlike bakterite kasvu pärssida..
Ja kui veri on pärit diabeetikust, häirib liigne glükoos hemolüüsi mustrite nõuetekohast arengut.
Aluselise agari tüübi valik
Vere agari valmistamiseks kasutatav alusagar võib olla väga lai. Nende hulgas on: toitaineagar, aju südame infusiooniagar, trüptikaasi sojaagar, Müeller Hintoni agar, Thayer Martin agar, Columbia agar, Brucella agar, Campylobacter agar jne..
Vere agari kasutamine vastavalt selle valmistamiseks kasutatavale alusele
Toiteagar
See alus on kõige vähem kasutatud, sest see kasvab peamiselt mittevajalikke baktereid, nagu enteerilised batsillid, Pseudomonas sp, S. aureus, Bacillus sp, muu hulgas. Streptococcus'e isoleerimine ei ole soovitatav.
Südame aju infusiooniagar (BHI)
See on üks kõige sagedamini kasutatavaid vere agaripõhiseid aluseid, kuna sellel on enamiku bakterite, sealhulgas ka bakterite kasvu jaoks vajalikud toitained. Streptococcus sp ja muud nõudlikud bakterid. Kuigi hemolüüsi mustrid ei ole asjakohased.
Selle alusega kasutatakse tavaliselt lambavere.
Samuti võib valmistada vere agarivariante, kus teatud mikroorganismide eraldamiseks lisatakse teisi ühendeid. Näiteks isoleerivad aju südame infusiooni agar, mida on täiendatud küüliku verega, tsüstiiniga ja glükoosiga Francisella tularensis.
Arvestades, et tsüstiini telluuriga on kasulik eraldada Corynebacterium diphteriae. Võite kasutada inim- või lambavere.
Esimesena näeb beeta-hemolüüs välja nagu kitsas halo, samas kui teine on halo palju laiem.
Samamoodi kasutatakse seda alust koos bacitraciniga, maisitärklisega, hobuse verega ja teiste rikastamise lisanditega (IsoVitaleX) perekonna isoleerimiseks. Haemophilus sp hingamisteede proovidest.
Kui lisate antibiootikumide kloramfenikool - gentamütsiini või penitsilliini - streptomütsiini kombinatsiooni hobuse verega, on see ideaalne nõudlike patogeensete seente eraldamiseks isegi suurema saagisega kui Sabouraudi glükoosiagar. See on eriti kasulik isoleerimisel Histoplasma capsulatum.
Tryptive sojauba
See baas on kõige soovitatavam hemolüüsi ja diagnostiliste testide, näiteks optoquiini ja batsitratsiini taksonite paremaks jälgimiseks. See on klassikaline vere agar, mida kasutatakse rutiinselt.
Selle alusega saab valmistada ka spetsiaalse vere agari Corynebacterium diphteriae, koos telluuri tsüstiiniga ja lambaliha verd.
Samuti on selle agari kombinatsioon lambavere ja kanamütsiin-vankomütsiiniga ideaalne anaeroobide kasvuks, eriti Bacteroides sp.
Agar Müeller Hinton
Seda verd täiendatud baasi kasutatakse nõutavate mikroorganismide, nagu Streptococcus sp.
Samuti on see kasulik selliste bakterite eraldamiseks Legionella pneumophila.
Agar Thayer Martin
See keskkond on ideaalseks alusteks vere agarile, kui kahtlustatakse Neisseria perekonda Neisseria meningitidis, sellest ajast alates N. gonorrhoeae ei kasva vere agaril.
Samuti on see mõeldud tundlikkuse testide läbiviimiseks Neisseria meningitidis.
Agar Columbia
See alus sobib suurepäraselt mao biopsiate proovide külvamiseks Helicobacter pylori.
Sööde valmistatakse, lisades 7% lambavere, mis on defibrineeritud antibiootikumidega (vankomütsiin, trimetoprim, amfoteritsiin B ja tsefsulodiin), et piirata teiste tüüpi bakterite kasvu, mis võivad esineda.
See sama alus, mida täiendatakse inimese või lambavere, nalidikshappe ja kolistiiniga, on kasulik isoleerimiseks Gardnerella vaginalis. Samuti on see ideaalne mikroobivastase tundlikkuse hindamiseks sama mikroorganismi antibiootikumide suhtes.
Lisaks kasutatakse seda anaeroobide kasvatamiseks vere agari valmistamiseks, lisades aminoglükosiide ja vankomütsiini..
See alus võimaldab meil hemolüüsi mustreid nõuetekohaselt jälgida.
Brucella Agar
See keskkond, mida kasutatakse vere agarina koos K-vitamiini lisamisega, on ideaalne anaeroobsete bakterite kasvatamiseks. Sel juhul on soovitatav kasutada lambavere kasutamist.
Campylobacter agar
Campylobacter Agar, millele on lisatud 5% lambavere ja 5 antibiootikumi (tsefalotiin, amfoteritsiin B, trimetoprim, polümüksiin B ja vankomütsiin), on \ t Campylobacter jejuni väljaheites.
Ettevalmistus
Iga kommertsmaja toob pakendi tagaküljele ette juhised, kuidas valmistada liitri söötme. Vastava arvutuse saab teha soovitud koguse valmistamiseks vastavalt valitud aluse agarile.
Kaaluge ja lahustage
Alusagar on dehüdreeritud (pulber), nii et see tuleb lahustada destilleeritud vees, mis on reguleeritud pH väärtusele 7,3.
Valitud aluselise agariga näidatud kogus kaalutakse ja lahustatakse sobivas koguses vees fiolis, seejärel kuumutatakse mõõduka kuumuseni ja segatakse pöörlevate liikumistega, kuni kogu pulber on lahustunud..
Steriliseerida
Pärast lahustamist steriliseeritakse autoklaavis 121 ° C juures 20 minutit.
Vere kogum
Autoklaavist lahkudes laske fiolil jahtuda, kuni temperatuur tõuseb vahemikus 40 kuni 50 ° C; on temperatuur, mida inimese nahk toetab ja samal ajal ei ole agar veel tahkestunud.
Selleks puudutab fiola käega ja kui soojus on talutav, siis on ideaalne temperatuur lisada vastav kogus defibrineeritud verd (50 ml liitri kohta). Segage õrnalt homogeniseerimiseks.
Vere koguhulga läbimine on otsustava tähtsusega, sest kui seda tehakse, kui sööde on väga kuum, purunevad punased verelibled ja sööde ei aita hemolüüsi jälgida.
Liiga külma lisamise korral moodustuvad tükid ja söötme pind ei pruugi flöödile korralikult teha.
Vala Petri tassidesse
Serveerige steriilsetes Petri tassides kohe pärast vereproovi homogeniseerimist. Igasse Petri tassi valatakse umbes 20 ml. See protseduur viiakse läbi laminaarse vooluhulga või kergema valgusti läheduses.
Petri tassides vere agarit teenindades ei tohiks plaadi pinnale jääda õhumulle. Sellisel juhul liigub Bunsen-põleti leek nende plaatide eemaldamiseks kiiresti üle plaadi..
Plaatidel lastakse tahkuda ja neid hoitakse külmutatud (2–8 ° C) pööratuna kuni kasutamiseni. Enne vere agariplaatide kasutamist tuleb külvata karastatud (lasta neil võtta toatemperatuur).
Valmistatud plaadid kestavad umbes 1 nädal.
Viited
- Bayona M.. \ T Helicobacter pylori. Rev Col Gastroenterol 2013; 28 (2): 94-99
- García P, Paredes F, Fernández del Barrio M. (1994). Praktiline kliiniline mikrobioloogia. Cadizi ülikool, 2. väljaanne. UCA väljaannete talitus.
- "Agari veri." Wikipedia, vaba entsüklopeedia. 10. detsember 2018, 14:55 UTC. 27. detsember 2018, 01: 49 en.wikipedia.org.
- Forbes B, Sahm D, Weissfeld A. (2009). Bailey & Scott'i mikrobioloogiline diagnoos. 12 ed. Argentina Panamericana S.A Toimetaja.
- CEDIVET Laboratory Veterinary Diagnostic Center. Guatemala Saadaval aadressil: trensa.com.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobioloogiline diagnoos. (5. väljaanne). Argentina, Redaktsioon Panamericana S.A..


