Acinetobacter baumannii omadused, morfoloogia, ainevahetus
Acinetobacter baumannii See on gramnegatiivne bakter, mis kuulub pseudomonas'i järjekorda. Kogu oma taksonoomiaajal on see olnud perekondades Micrococcus, Moraxella, Alcaligenes, Mirococcuscalco-aceticus, Herellea ja Achromobacter, kuni ta asus oma praeguses žanris 1968. aastal.
A. baumannii See on patogeenseks bakteriks, mida peetakse selle perekonna nakkuste kõige sagedasemaks kaasatuks. Ta on seotud mitmesuguste infektsioonidega nagu septitseemia, kopsupõletik ja meningiit..
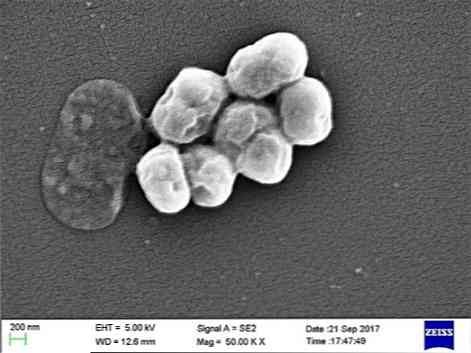
See on oportunistlik parasiit, millel on oluline haigestumus või haiglaravi. Mehhanilise ventilatsiooniga ülekanne on osutunud nakkuse oluliseks põhjuseks, eriti intensiivravi üksustes.
Vaatamata sellele, et seda peetakse madala kvaliteediklassi patogeeniks, on see võimeline suurendama oma virulentsust sagedaste nakkustega seotud tüvedes. Tal on suur võime arendada antibiootikumidele resistentsust ja multiresistentsust.
Haiglates edastatakse seda peamiselt töötajate kontakti kaudu, kasutades saastatud haigla materjale ja ka õhu kaudu lühikestel vahemaadel..
Maailma Tervishoiuorganisatsioon hõlmab A. baumannii resistentsete patogeenide loetellu, mille jaoks on hädavajalikud uued antibiootikumid, määrates esmatähtsusega 1. kategooria.
Indeks
- 1 Bioloogilised omadused
- 2 Morfoloogia
- 3 Ainevahetus
- 4 Vastupidavus antibiootikumidele
- 5 patoloogiat
- 6 Sümptomid
- 7 Ravi
- 8 Viited
Bioloogilised omadused
Kõik perekonna liigid Acinetobacter neil on laialt levinud erinevates looduslikes nišides. A. baumannii see võib loomulikult elada tervete inimeste nahas, olles võimeline koloniseerima limaskesta pinnad, mis on oluline epidemioloogiline reservuaar. Kuid elupaiga A. baumannii see on peaaegu eksklusiivne haiglaravile.
Nendel bakteritel puuduvad lipud või liikumises kasutatavad struktuurid. Siiski saavutavad nad liikumise struktuuride kaudu, mis võimaldavad neil laieneda ja tagasi tõmmata, ning keemilisi mehhanisme, nagu näiteks suure molekulmassiga eksopolüsahhariidi kile eritumine bakteri taga..
A. baumannii suudab koloniseerida suurel hulgal elavaid või inertseid keskkondi ning tal on suur võime pikema aja jooksul kunstlikel pindadel elada.
See võime on tõenäoliselt tingitud selle võimest vastu seista dehüdratsioonile, kasutada erinevaid süsinikuallikaid erinevate ainevahetusviiside kaudu ja võimalust moodustada biofilme. Sel põhjusel on tavaline, et see leidub haigla seadmetes, nagu kateetrid ja mehaanilised ventilatsiooniseadmed.
Morfoloogia
A. baumannii on kokkobatsill, mis on kookospähklite ja kepidude vahelises vormis. Nad mõõdavad 1,5 kuni 2,5 1–1,5 mikronit, kui populatsioonid on kasvu logaritmilises faasis. Need on sfäärilisemad, kui nad jõuavad statsionaarsesse faasi.
Metabolism
Bakter A. baumannii see ei ole glükoosi fermenter; see on range aeroobne, see tähendab, et ta vajab oma ainevahetuse jaoks hapnikku.
Pereliik Acinetobacter nad on ainsad Moraxellaceae sugukonnast, kellel puuduvad tsütokroom c oksüdaasid, mille puhul nad annavad oksüdaaside testides negatiivseid tulemusi.
A. baumannii see kasvab temperatuuridel, mis varieeruvad vahemikus 20–44ºC, optimaalne temperatuur on 30–35 ° C.
Vastupidavus antibiootikumidele
Antibiootikumide resistentsuse pidev genereerimine mitte ainult ei takista infektsioonide ravi ja kontrolli A. baumannii, see soodustab ka endeemiliste ja epideemiliste multiresistentsete tüvede valikut.
Mõned. \ T A. baumannii, mis soodustavad antibiootikumiresistentsust:
- Selle olemasolu β-laktamaasid annavad resistentsuse b-laktaamide suhtes.
- Spetsiifiliste ensüümide, nagu ammoniglükosiid-3'-fosfotransferaas VI, valmistamine inaktiveerib amikatsiini..
- Oksasillinaasi OXA-51 olemasolu hüdrolüüsib penitsilliine ja karbapeneeme.
- Reflukspumpade olemasolu ja üleekspressioon, mis on pumbad, mis väljutavad tsütoplasma läbivaid väikeseid molekule väljaspool rakku, vähendades seeläbi nende tundlikkust antibiootikumide suhtes.
Loodud biofilmid A. baumannii nad muudavad mikroorganismide ainevahetust, vähendades nende tundlikkust antibiootikumide suhtes, pakkudes lisaks füüsilist barjääri suurte molekulide vastu ja takistades bakterite dehüdratsiooni..
Patoloogiad
A. baumannii koloniseerib uue peremehe nakatunud inimestega või saastunud meditsiinivarustusega. Esiteks kleepub see bakter nahale ja limaskestale. Reprodutseerimiseks peab see ellu jääma antibiootikumide ja inhibeerivate ainete ning nende pindade seisundi.
Bakterite arvu suurenemine limaskesta pindadel, eriti haiglaravi tingimustes, mis puutuvad kokku intravaskulaarsete kateetrite või endotrahheaalsete torudega, võivad soodustada hingamisteede ja vereringe infektsiooni riski..
Haiglates sõlmitud kopsupõletik on kõige levinum nakkus A. baumanii. Tavaliselt sõlmitakse intensiivravi üksused patsientidel, kes saavad mehaaniliselt hingamist.
A. baumanii Samuti on see põhjustanud suuri probleeme sõjajärgse traumaga sõjaväelaste infektsioonide tõttu, eriti Iraagis ja Afganistanis. Täpsemalt osteomüeliidi ja pehmete kudede infektsioonide tõttu, mis võivad põhjustada nekroosi ja tselluliiti.
Samuti on oht meningiidi tekkeks A. baumanii neurokirurgiast taastuvatel patsientidel.
Isikud, kes on vastuvõtlikud infektsioonidele A. baumanii hulka kuuluvad need, mida on varem kasutatud antibiootikumide, suurte operatsioonide, põletuste, traumade, immunosupressiooni või invasiivsete meditsiiniseadmete, peamiselt mehaanilise ventilatsiooni kasutamisel, intensiivraviüksustes.
Sümptomid
Puuduvad spetsiifilised sümptomid nakkuste tekkeks A. baumanii. Kõigil selle bakteri poolt põhjustatud erinevatel infektsioonidel on oma iseloomulikud sümptomid.
Üldiselt võivad kaasneda infektsioonide sümptomid A. baumanii või teisi oportunistlikke baktereid Klebsiella pneumoniae ja Streptococcus pneumoniae, võivad olla palavik, külmavärinad, lööve, valulik urineerimine, kiireloomuline vajadus urineerida sageli, segasus või muutunud vaimsed seisundid, iiveldus, lihasvalud, valu rinnus ja köha.
Ravi
Antibiootikumid infektsioonide raviks A. baumannii need on äärmiselt piiratud, kuna neil on suur vastupanuvõime ja multiresistentsus. Seetõttu on oluline määrata iga tüve tundlikkus erinevate antibiootikumide suhtes, et tagada iga ravi efektiivsus.
Pidades silmas resistentsust karbapeneemide suhtes, on kasutatud polümüksiini, eriti kolistiini, kasutamist, kuigi neil on suhteliselt madal resistentsusindeks ja selle kõrvaltoimed neerudele..
Siiski on kolistiini suhtes resistentsed tüved juba avastatud. Nende antibiootikumide resistentsuse alternatiivina on kasutatud kombinatsioonravi.
Viited
- Bergogne-Bérézin, E. & Towner, K.J. Acinetobacter spp. haiglaravi: mikrobioloogilised, kliinilised ja epidemioloogilised tunnused. Clin Microbiol Rev, 9 (1996), lk. 148-165.
- Fournier, P.E., Richet, H. (2006). Epidemioloogia ja kontroll Acinetobacter baumanii tervishoiuasutustes. Kliinilised nakkushaigused, 42: 692-9.
- Hernández Torres, A., García Vázquez, E., Yagüe, G. &, Gómez Gómez, J. (2010) Acinetobacter baumanii multiresistentsed: praegune kliiniline olukord ja uued perspektiivid Hispaania ajakiri Chemotherapy, 23 (1): 12-19.
- Maragakis LL, Perl TM. Acinetobacter baumanii: epidemioloogia, antimikroobse resistentsuse ja ravi võimalused. Clin Infec Dis 2008; 46: 1254-63.
- McConnell, M.j., Actis, L. & Pachón, J. (2013) Acinetobacter baumannii: inimese nakkused, patogeneesi ja loomade mudeleid mõjutavad tegurid. FEMS Microbiology Reviews, 37: 130-155.
- Peleg, A.Y., Seifert, H. & Paterson, D.L. (2008). Acinetobacter baumannii: eduka patogeeni tekkimine. Clinical Microbiology Reviews, 21 (3): 538-82.
- Vanegas-Múnera, J. M., Roncancio-Villamil, G. & Jiménez-Quiceno, J.N. (2014). Acinetobacter baumannii: kliiniline tähtsus, resistentsusmehhanismid ja diagnoos. CES Medicine Journal, 28 (2): 233-246.


