Mangaanoksiid (MnO2) keemiline struktuur, omadused ja kasutusalad
The mangaanoksiid (MnO2) on anorgaaniline keemiline ühend, mis on moodustatud oksüdatsiooninumbriga +4 ja hapnikuga elemendi mangaanist, mille oksüdeerimisel on oksüdatsiooniarv -2. Seda tuntakse ka mangaani (IV) oksiidi ja mangaananhüdriidi nimede all.
See on tume kuni must kohv. See on oma olemuselt mineraalne pirolusiit, must ja kristalliseerunud moodustavad dendriidid (hargnenud pikenemine). Seda võib saada musta jäägina etüleeni ja kaaliumpermanganaadi vahelises reaktsioonis pärast glükooli moodustumist kaaliumpermanganaadi oksüdeeriva toimega..

See on klaasitööstuses väga oluline oksüdeeriva aine iseloomu tõttu, kuna see kõrvaldab mustade ühendite rohelise värvi ja muudab need rauda..
Indeks
- 1 Keemiline struktuur
- 2 Atribuudid
- 3 Kasutamine
- 3.1 Katalüsaatorina
- 4 Mõju tervisele
- 5 Viited
Keemiline struktuur
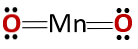
Ühendi keemiline struktuur vastab anhüdriidi keemilisele struktuurile, mitte aluselise oksiidi struktuurile, nagu oleks oodata, sest see koosneb metallist ja mittemetallist.
See eriline juhtum tuleneb mangaani käitumisest erinevates oksüdatsioonitingimustes. Seega moodustavad oksüdatsioonitingimused +2 ja +3 oksiidid MnO ja Mn2O3 vastavalt sellele moodustavad nad veega reageerimisel vastavalt mangaanhüdroksiidi ja mangaanhüdroksiidi.
Mn2O3 kergelt happelises keskkonnas käitub see anhüdriidina. Oksüdatsiooniastmetega +4, +6 ja +7 on MnO2, MnO3 ja MnO4 nad moodustavad veega reageerimisel happeid.
Kergelt happelises keskkonnas MnO2 see käitub nagu põhioksiid, nii et see võib moodustada vastava hüdroksiidi.

Tuleb meeles pidada, et sel juhul ei mainita amfoteerseid omadusi, mille kohaselt võib ühend toimida happena või alusena. See on Mn käitumise erijuhtum.
Omadused
Kasutamine
- Seda kasutatakse mangaani allikana
- Hapnikuna leelispatareides
- Värvid klaasist, keraamikast ja portselanist.
- Kloori ja joodi saamiseks.
- Vesinikperoksiidi lagunemisel gaasilise hapniku ja vee moodustamiseks.
- Kaaliumkloriidi lagunemisreaktsioonis gaasilise hapniku ja kaaliumkloriidi tootmiseks.
- Lahustatud atsetoonis või diklorometaanis, oksüdeerib primaarsed alkoholid aldehüüdideks ja sekundaarsed ketoonideks.
- Leelispatareide tootmine.
Katalüsaatorina
See kehtib oksiidide redutseerimise reaktsioonide kohta, näiteks sulfidide, nagu H, eemaldamiseks2S ja katioonid nagu Fe+2 ja Mn+2 , põhjavees leiduva arseeni ja raadio, mis on seda tüüpi ühenditega saastunud.
See saastumine võib tekkida mürgiste materjalide kontrollimatu ladestamise, saastunud pinnase pesemise või vee ekstraheerimise ajal keemiliste elementide olemasolu tõttu..
MnO2 Filtrina kasutatavast pürolüüsist saadud kõrge puhtusaste on kõige tõhusam vahend selle klassi lisandite eemaldamiseks põhjaveest.
Mõju tervisele
- Vältida kokkupuudet nahaga.
- Kokkupuute korral peske vastav ala.
- Ärge hingake pulbreid sisse.
- Silma sattumisel võib näha ärritust ja punetust. Peske rohke veega, laske veel läbi silmade ja pöörduge tõsise meditsiiniabi poole.
- Kokkupuutel nahaga on täheldatud ärritust ja punetust. Peske kahjustatud piirkonda rohke veega ja seebiga.
- Pikaajaline kokkupuude nahaga eemaldab teie loodusliku rasva, põhjustades dermatiiti.
- Sissehingamine võib põhjustada gripitaolist seisundit (metalliaurud). Seda seisundit iseloomustab kõrge palavik, külmavärinad, suukuivus ja kõri, lihasvalu ja peavalu.
- See võib ärritada hingamisteid ja suurendada hingamisteede infektsioonide (pneumoonia) esinemissagedust. Mürgine toime anorgaaniliste mangaanisoolade imendumise kaudu kopsudesse on ebatõenäoline, kuid võib tekkida krooniline mürgistus..
- Krooniline mangaanoksiidi tolmu või suitsuga kokkupuude pika aja jooksul võib mõjutada kesknärvisüsteemi ja põhjustada Parkinsoni tõve, kõndimisraskuste, lihaskrampide ja käitumismuutuste tekkimist..
- Allaneelamine võib põhjustada kõhuvalu ja iiveldust.
- See ei ole tuleohtlik, kuid aitab levitada tuld hõõguvatesse materjalidesse. Kuumutades temperatuurini üle 535 ° C, laguneb aine mangaanoksiidiks (III) Mn2O3 ja hapnik, mis on tuleohtlik ja suurendab tuleohtu. Sellisel juhul tuleb tulekahju kustutada vahu või süsinikdioksiidiga.
- Lekke korral ärge manipuleerige ühendit ilma isikliku kaitseta.
- Hoida ühendit tihedalt suletud mahutites, külmas ja kuivas kohas ning eemal kokkusobimatutest ainetest nagu orgaaniline materjal ja süttiv materjal.
- Ladustamiskoht peab olema kuiv ja omama põrandakindlat happe korrosiooni ning hea äravooluga..
- Tuleb kasutada isiklikke kaitsevahendeid, nagu kindad, kaitseprillid, aurutõrjefiltrid, tolm ja suits.
Viited
- B, (2015), mangaandioksiid, Royal Society of Chemistry - Chemistry world, mis on saadud keemiaworld.com-st
- Karal, (2014), Mangnesooksiid, Ohutuskaart, Taastatud, kuning.com.mx
- Teie virtuaalne õpetaja (2015-02-25). Mangaani anorgaanilised ühendid (erijuhtum 1) - teoreetiline õppetund), mis on saadud aadressilt youtube.com
- Ecured, (s.f), mangaandioksiid, taastatud ecured.cu
- Angarita G, Johnny., (2017), mangaandioksiid: erakordne tehnoloogia. Hydrotec, hüdrotecocr.com-lt
- Fernández, G., (2015), MnO mangaandioksiid2/ atsetoon, Orgaaniline keemia, Taastati quimicaorganica.netist
- Tronox, (2011), mangaandioksiid, ohutuskaart, taastatud, tronox.com


