Süsiniktetrakloriidi (CCl4) struktuur, omadused, kasutusalad, toksilisus
The tetrakloriid See on värvitu vedelik, kergelt magusa lõhnaga, sarnane eetri ja kloroformi lõhnaga. Selle keemiline valem on CCl4, ja see moodustab kovalentse ja lenduva ühendi, mille aur on tihedam kui õhk; See ei soodusta elektrit ega ole tuleohtlik.
Seda leidub atmosfääris, jõgede vees, merel ja merepinna setetes. Arvatakse, et punane vetikates esinev süsiniktetrakloriid sünteesitakse sama organismi poolt.
Atmosfääris toodetakse seda kloori ja metaani reaktsioonil. Tööstuslikult toodetud süsiniktetrakloriid siseneb ookeani, peamiselt mere-õhu liidese kaudu. Hinnanguliselt on selle atmosfäärirõhk => ookeaniline 1,4 x 1010 g / aastas, mis moodustab 30% atmosfääri süsiniktetrakloriidist.
Indeks
- 1 Peamised omadused
- 2 Struktuur
- 3 Füüsikalised ja keemilised omadused
- 4 Kasutamine
- 4.1 Keemiline tootmine
- 4.2 Külmutusainete tootmine
- 4.3 Tulekahju pärssimine
- 4.4 Puhastamine
- 4.5 Keemiline analüüs
- 4.6 Infrapuna spektroskoopia ja tuuma magnetresonants
- 4.7 Lahusti
- 4.8 Muud kasutusalad
- 5 Toksilisus
- 5.1 Hepatotoksilised mehhanismid
- 5.2 Mürgine toime neerusüsteemile ja kesknärvisüsteemile
- 5.3 Inimese kokkupuute mõju
- 5.4 Mürgine koostoime
- 6 Molekulidevaheline interaktsioon
- 7 Viited
Peamised omadused
Süsiniktetrakloriidi toodetakse tööstuslikult metaani termilise kloorimise teel, kusjuures metaan reageeritakse kloorgaasiga temperatuuril 400–430 ° C. Reaktsiooni käigus saadakse toorprodukt vesinikkloriidhappe kõrvalsaadusega.
Samuti toodetakse seda tööstuslikult süsinikdisulfiidi meetodil. Kloor ja süsinikdisulfiid pannakse reageerima temperatuuril 90 ° C kuni 100 ° C, kasutades katalüsaatorina rauda. Seejärel töödeldakse toorprodukti fraktsioneerimise, neutraliseerimise ja destilleerimise teel.
CCl4 on kasutanud mitmesuguseid kasutusviise, muu hulgas: rasvade, õlide, lakkide jne lahustid; riiete keemiline puhastus; pestitsiidide, põllumajanduse ja fungitsiidse fumigatsiooni ja nailonitootmise puhul. Siiski, hoolimata selle suurest kasulikkusest, on selle kasutamine suure toksilisuse tõttu osaliselt välistatud.
Inimestel tekitab see mürgist toimet nahale, silma ja hingamisteedele. Kuid selle kõige kahjulikum toime avaldub kesknärvisüsteemi, maksa ja neerude toimimises. Neerukahjustus on ehk peamine süsiniktetrakloriidi toksilisele toimele põhjustatud surma põhjus.
Struktuur
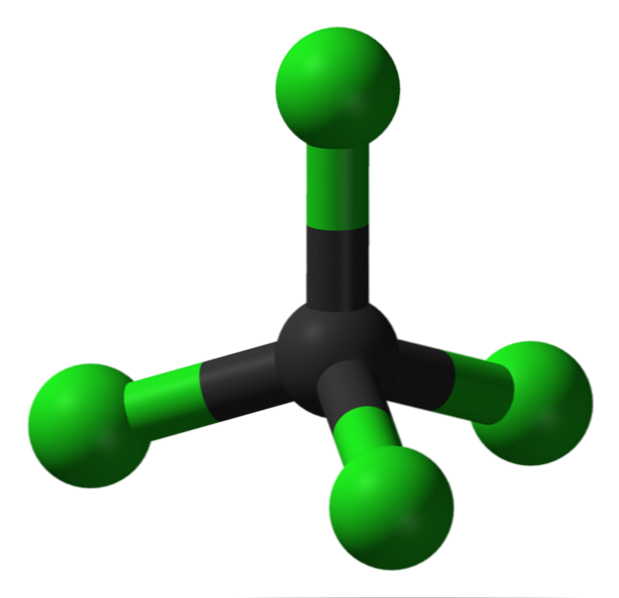
Pildil on näha süsiniktetrakloriidi struktuur, mis on tetraedriline geomeetria. Pange tähele, et Cl-aatomid (rohelised sfäärid) on orienteeritud süsiniku ümbruses olevasse ruumi (must sfäär), tetraeedri joonistamisega.
Samuti väärib märkimist, et kuna kõik tetraeedri tipud on identsed, on struktuur sümmeetriline; see tähendab, et ei ole oluline, kuidas CCl molekuli pööratakse4, See on alati sama. Siis, kuna CCl roheline tetraeeder4 on sümmeetriline, selle tagajärjel puudub püsiv dipoolmoment.
Miks? Kuna C-Cl sidemed on polaarsed Cl suurema elektronegatiivsuse tõttu C suhtes, siis need hetked tühistatakse vektoriliselt. Seetõttu on see apolaarne klooritud orgaaniline ühend.
Süsinik on täielikult klooritud CCl-s4, mis on võrdne suure oksüdatsiooniga (süsinik võib moodustada maksimaalselt neli sidet klooriga). See lahusti ei kaldu elektronid kaotama, see on aprotoonne (see ei sisalda vesinikke) ja see kujutab endast transpordivahendit ja väikest kloori ladustamist..
Füüsikalised ja keemilised omadused
Valem
CCl4
Molekulmass
153,81 g / mol.
Füüsiline välimus
See on värvitu vedelik. See kristalliseerub monokliiniliste kristallide kujul.
Lõhn
Esitab iseloomuliku lõhna, mis esineb teistes klooritud lahustites. Lõhn on aromaatne ja mõnevõrra magus, sarnane tetrakloroetüleeni ja kloroformi lõhnaga.
Keemistemperatuur
170,1 ° F (76,8 ° C) kuni 760 mmHg.
Sulamistemperatuur
-9ºF (-23ºC).
Lahustuvus vees
See on vees halvasti lahustuv: 1,16 mg / ml 25 ° C juures ja 0,8 mg / ml 20 ° C juures. Miks? Kuna vesi, väga polaarne molekul, ei tunne afiinsust süsiniktetrakloriidi suhtes, mis on apolaarne.
Lahustuvus orgaanilistes lahustites
Molekulaarse struktuuri sümmeetria tõttu on süsiniktetrakloriid mittepolaarne ühend. Seetõttu on see segunev alkoholi, benseeni, kloroformi, eetri, süsinikdisulfiidi, petrooleetri ja tööstusbensiiniga. Samuti lahustub see etanoolis ja atsetoonis.
Tihedus
Vedelas olekus: 1,59 g / ml temperatuuril 68 ° F ja 1,594 g / ml 20 ° C juures.
Tahkes olekus: 1,831 g / ml temperatuuril -186 ° C ja 1,809 g / ml temperatuuril -80 ° C.
Stabiilsus
Üldiselt inertne.
Sööbiv toime
Reageerib mõnede plastide, kummide ja katete vormidega.
Süütepunkt
See ei ole väga tuleohtlik, näidates süütepunkti alla 982 ° C.
Isesüttimine
982 ° C (1800 ° F; 1255 K).
Auru tihedus
5,32 õhu suhtes, mida võetakse võrdlusväärtuseks 1.
Aururõhk
91 mm Hg 68 ° F juures; 113 mmHg temperatuuril 77 ° F ja 115 mmHg temperatuuril 25 ° C.
Lagunemine
Tulekahju korral moodustub kloriid ja fosgeen, tugevalt mürgine ühend. Samamoodi laguneb see samadel tingimustel vesinikkloriidiks ja süsinikmonooksiidiks. Vee juuresolekul kõrgel temperatuuril võib see põhjustada vesinikkloriidhapet.
Viskoossus
2,03 x 10-3 Pa · s
Lõhnalävi
21,4 ppm.
Murdumisnäitaja (ηD)
1,4607.
Kasutamine
Keemiline tootmine
-See toimib klooriva ainena ja / või lahustina orgaanilise kloori valmistamisel. Samuti sekkub see monomeerina nailoni tootmisel.
-Toimib lahustina kummist tsementi, seebi ja insektitsiidide valmistamisel.
-Seda kasutatakse klorofluorosüsivesinike propellendi valmistamiseks.
-C-H-sidemeta süsiniktetrakloriidil ei ole vabade radikaalide reaktsioone, nii et see on kasulik lahusti halogeenimiseks kas elementaarse halogeeni või halogeenimisreagendi, näiteks N-bromosuktsiinimiidi abil..
Külmutusainete tootmine
Seda kasutati klorofluorosüsivesiniku, külmutusagensi R-11 ja triklorofluorometaani, külmutusagensi R-12 tootmisel. Need külmutusagensid hävitavad osoonikihi, mistõttu soovitasid nad nende kasutamise lõpetamist vastavalt Montreali protokolli soovitustele..
Tulekahju pärssimine
20. sajandi alguses hakati tulekustutitena kasutama süsiniktetrakloriidi, mis põhineb ühendi omadustel: see on lenduv; selle aur on õhust raskem; See ei ole elektrijuht ega ole väga tuleohtlik.
Kuumutamisel muutub süsiniktetrakloriid raskeks auruks, mis katab põlemissaadused, eraldades need õhus olevast hapnikust ja põhjustades tulekahju surma. See sobib naftatulekahjude ja -vahendite vastu võitlemiseks.
Kui temperatuur on üle 500 ° C, võib tetrakloorsüsinik reageerida veega, põhjustades fosgeeni, mürgist ühendit, mistõttu tuleb kasutamise ajal tähelepanu pöörata ventilatsioonile. Lisaks võib see metalli naatriumiga plahvatuslikult reageerida, vältides selle metalli kasutamisel tulekahjudes.
Puhastamine
Süsiniktetrakloriidi on kasutatud riiete ja muude kodus kasutatavate materjalide keemiliseks puhastamiseks. Lisaks kasutatakse seda metalli tööstusliku rasvaärastina, mis sobib suurepäraselt rasva ja õli lahustamiseks.
Keemiline analüüs
Seda kasutatakse boori, bromiidi, kloriidi, molübdeeni, volframi, vanadiini, fosfori ja hõbeda tuvastamiseks..
Infrapuna spektroskoopia ja tuuma magnetresonants
-Seda kasutatakse lahustina infrapuna-spektroskoopias, kuna süsiniktetrakloriidil ei ole märkimisväärset neeldumist ribades> 1600 cm-1.
-Seda kasutati lahustina tuumamagnetresonantsis, kuna see ei mõjutanud tehnikat, kuna tal ei olnud vesinikku (see on aprotoonne). Kuid selle toksilisuse tõttu ja kuna lahusti võimsus on madal, on süsiniktetrakloriid asendatud deuteerunud lahustitega..
Lahusti
Mittepolaarse ühendi omadus võimaldab kasutada süsiniktetrakloriidi lahustina õlide, rasvade, lakkide, lakkide, kummivahade ja vaigude jaoks. Samuti võib see joodi lahustada.
Muud kasutusalad
-See on lava lampide oluline komponent, sest tänu oma tihedusele annab tetrakloriid kaalu vahale.
-Kasutatakse templikollektsionääride poolt, kuna see näitab, et tempelidel on vesimärke kahjustamata.
-Seda kasutatakse pestitsiidina, fungitsiidina ja terade pihustamisel putukate kõrvaldamiseks.
-Metallilõikusprotsessis kasutatakse seda määrdeainena.
-Seda on kasutatud veterinaarmeditsiinis anthelmintikumina Fasciola hepatica poolt põhjustatud fasciolasis'e ravis lammastel..
Toksilisus
-Süsiniktetrakloriid võib imenduda hingamisteede, seedetrakti, silmade ja naha kaudu. Allaneelamine ja sissehingamine on väga ohtlikud, sest need võivad põhjustada aju, maksa ja neerude pikaajalist tõsist kahjustust.
-Kokkupuude nahaga tekitab ärritust ja võib pikas perspektiivis põhjustada dermatiiti. Silma sattumisel tekitab ärritust.
Hepatotoksilised mehhanismid
Peamised maksakahjustust põhjustavad mehhanismid on oksüdatiivne stress ja kaltsiumi homöostaasi muutumine..
Oksüdatiivne stress on tasakaalustamatus reaktiivsete hapniku liikide tootmise ja keha võime vahel luua oma rakkudes oksüdatiivseid protsesse vähendav keskkond..
Normaalse redoksoleku tasakaalustamatus võib põhjustada toksilisi toimeid peroksiidide ja vabade radikaalide tootmisel, mis kahjustavad rakkude kõiki komponente.
Süsiniktetrakloriid metaboliseerub vabade radikaalide tootmisel: Cl3C. (radikaal-triklorometüül) ja Cl3COO. (radikaalne triklorometüülperoksiid). Need vabad radikaalid tekitavad lipoperoksüdatsiooni, mis põhjustab maksa ja kopsu vigastusi.
Vabad radikaalid põhjustavad ka maksa rakkude plasmamembraani rebenemist. See tekitab kaltsiumi tsütosoolse kontsentratsiooni suurenemise ja kaltsiumi sekvestratsiooni rakusisese mehhanismi vähenemise.
Kaltsiumi intratsellulaarne suurenemine aktiveerib ensüümi fosfolipaas A2 mis mõjutab membraani fosfolipiide, raskendades selle mõju. Lisaks esineb neutrofiilide ja hepatotsellulaarse vigastuse infiltratsioon. ATP ja glutatiooni rakkude kontsentratsioon väheneb, mis põhjustab ensümaatilist inaktivatsiooni ja raku surma.
Mürgine toime neerusüsteemile ja kesknärvisüsteemile
Süsiniktetrakloriidi toksiline toime avaldub neerusüsteemis, kus uriini ja keha vee kogunemine väheneb. Eriti kopsudes ja metaboolsete jäätmete kontsentratsiooni tõus veres. See võib põhjustada surma.
Kesknärvisüsteemi tasandil on kaasatud närviimpulsside aksonaalne juhtimine.
Inimese kokkupuute mõju
Lühike kestus
Silmade ärritus; mõju maksale, neerudele ja kesknärvisüsteemile võib põhjustada teadvuse kadu.
Pikk kestus
Dermatiit ja võimalikud kantserogeensed toimed.
Mürgine koostoime
Paljude intoksikatsioonijuhtumite vahel on seos tetrakloorsüsiniku ja alkoholi tarbimisega. Liigne alkoholi tarbimine põhjustab maksakahjustusi, põhjustades mõnel juhul maksatsirroosi.
On täheldatud, et tetrakloorsüsiniku toksilisus suureneb barbituraatidega, kuna neil on mingi sarnane toksiline toime.
Näiteks, neerude tasemel, vähendavad barbituraadid uriini eritumist, see barbituraatide toime sarnaneb süsiniktetrakloriidi toksilisele toimele neerufunktsioonile..
Intermolekulaarsed koostoimed
CCl4 Seda võib pidada roheliseks tetraeederiks. Kuidas see teiste inimestega suhtleb?
Olles apolaarne molekul, millel ei ole püsivat dipoolmomenti, ei saa see dipool-dipoolijõudude vahel toimida. Et hoida oma molekule vedelikus kokku, peavad kloori aatomid (tetraeedri tipud) mingil viisil omavahel suhtlema; ja need õnnestuvad tänu Londoni hajutamisjõududele.
Cl aatomite elektroonilised pilved liiguvad ja lühikesteks hetkedeks tekitavad rikkalikke ja kehvaid elektronide piirkondi; see tähendab, et nad loovad vahetu dipooli.
Elektronide δ-rikkalik piirkond põhjustab naabermolekuli Cl-aatomi polariseerumise: Clδ-δ+Seega võib kahte Cl aatomit hoida piiratud aja jooksul koos.
Kuid neil on miljoneid CCl molekule4, interaktsioonid muutuvad piisavalt tõhusaks, et moodustada normaalsetes tingimustes vedelikku.
Lisaks suurendab iga C-ga kovalentselt seotud neli Cl-d nende interaktsioonide arvu; nii palju, et see keeb 76,8 ° C juures, kõrge keemistemperatuuriga.
CCl keemistemperatuur4 see ei saa olla suurem, sest tetrahedra on teiste apolaarsete ühenditega (nagu ksüleen, mis keeb temperatuuril 144 ° C) suhteliselt väike..
Viited
- Hardinger A. Steven. (2017). Illustreeritud orgaanilise keemia sõnastik: süsiniktetrakloriid. Välja otsitud andmebaasist: chem.ucla.edu
- Kõik Siyavula. (s.f.). Intermolekulaarsed ja interatomilised jõud. Välja otsitud andmebaasist: siyavula.com
- Carey F. A. (2006). Orgaaniline keemia (Kuues väljaanne). Mc Grawi mägi.
- Wikipedia. (2018). Süsiniktetrakloriid. Välja otsitud andmebaasist: en.wikipedia.org
- PubChem. (2018). Süsiniktetrakloriid. Välja otsitud andmebaasist: pubchem.ncbi.nlm.nih.gov
- Keemiline raamat. (2017). Süsiniktetrakloriid. Välja otsitud: chemicalbook.com


