Elektronide mere teooria Põhialused, omadused ja puudused
The elektronide teooria See on hüpotees, mis seletab erakordset keemilist nähtust, mis esineb metalli sidemete vahel madala elektronegatiivsusega elementide vahel. See puudutab elektronide jagamist erinevate aatomite vahel, mis on seotud metallist võlakirjadega.
Nende linkide vaheline elektrooniline tihedus on selline, et elektronid on ümber paigutatud ja moodustavad "mere", kus nad vabalt liikuvad. Seda võib väljendada ka kvantmehaanika abil: mõned elektronid (tavaliselt üks kuni seitse aatomi kohta) on paigutatud orbitaalidesse, millel on mitu keskpinda, mis on venitatud üle metalli..
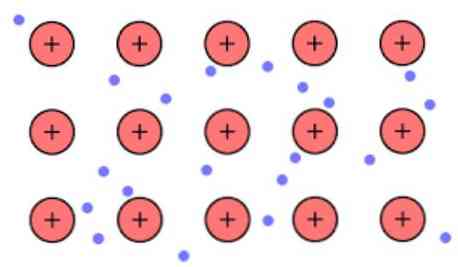
Samuti säilitavad elektronid mõnda asukohta metallist, kuigi elektroonilise pilve tõenäosusjaotusel on mõnede konkreetsete aatomite ümber tihedam. Selle põhjuseks on asjaolu, et teatud voolu rakendamisel näitavad nad oma juhtivust teatud suunas.
Indeks
- 1 Elektronide mere teooria alused
- 2 Atribuudid
- 2.1. Kihtide nihutamine
- 2.2 Elektroonide mere teooria metallkristallides
- 3 Teooria puudused
- 4 Viited
Elektronide mere teooria alused
Metallelementidel on suur kalduvus annetada elektronid oma viimasest energiatasemest (valentsikiht), kuna nende ionisatsioonienergia on teiste elementidega võrreldes nii madal.
Seda teades võib iga metallilist elementi lugeda katiooniks, mis on seotud viimase energia taseme elektroniga, mis oleks kalduvus annetada..
Selle metalli võttes suur aatomite arv on omavahel seotud, siis võib eeldada, et metallist moodustab rühma metalli katioonide, mis on uputatud omamoodi mere valentsielektroni mis on suur delokaliseerimisele.
Arvestades elektrostaatiline jõud vaheline külgetõmme meedia (positiivne laeng) ja elektronide (negatiivse laenguga) olla metalli aatomitest tugevalt imagines deloka- valentsielektroni käitub elektrostaatiline liimiga säilitab aheldatud metalli katioonidele.
Sel viisil võib järeldada, et mida suurem on metallide valentsikihis olevate elektronide arv, on sellist tüüpi elektrostaatiline liim suurem tugevus.
Omadused
Elektronide mere teooria pakub lihtsat seletust metalliliikide omadustele, nagu resistentsus, juhtivus, plastsus ja tempermalentsus, mis varieeruvad metallist..
On avastatud, et metallidele antav resistentsus on tingitud nende elektronide suurest ümberpaigutamisest, mis tekitab väga suure ühtekuuluvuse jõu selle moodustavate aatomite vahel..
Sel moel tuntakse plastilisust kui teatud materjalide võimet võimaldada nende struktuuri deformeerumist, ilma et see saaks piisavalt puruneda, kui see allutatakse teatud jõududele..
Offshoring kihtide kujul
Mõlemad nõtkus ja deformeeritavus metallist need tingitud asjaolust, et valentsielektroni on delokaliseeritud kõikides suundades kihist, mille põhjustab neil liikuda üksteisest üle toime vastu välist jõudu, vältida metallkonstruktsiooni purunemist, kuid võimaldades selle deformatsiooni.
Samamoodi võimaldab delokaliseeritud elektronide liikumisvabadus elektrivoolu, mistõttu metallide elektrit juhtivus on väga hea.
Lisaks võimaldab see elektronide vaba liikumise nähtus kineetilise energia ülekandmist metalli erinevate piirkondade vahel, mis soodustab soojuse ülekannet ja põhjustab metallide kõrge soojusjuhtivuse..
Elektroonika mere teooria metallikristallides
Kristallid on tahked ained, millel on füüsikalised ja keemilised omadused, nagu tihedus, sulamispunkt ja kõvadus, mis on kindlaks määratud selliste jõududega, mis teevad osakesi, mis muudavad need kokku..
Teatud mõttes peetakse metalli tüüpi kristallideks kõige lihtsamaid struktuure, sest kristallvõrgu iga punkt on hõivatud metalli aatomi enda poolt..
Selles mõttes on kindlaks tehtud, et metallkristallide struktuur on üldiselt kuupmeetri ja keskendub nägudele või kehale..
Kuid need liigid võivad olla ka kuuskantsed ja neil on üsna kompaktne pakend, mis annab neile sellist tohutut tihedust, mis on iseloomulik.
Selle struktuurse põhjuse tõttu erinevad metallikristallides moodustunud sidemed teistest kristallidest. Elektronid, mis võivad moodustada sidemeid, on ümber kristallilise struktuuri, nagu eespool selgitatud.
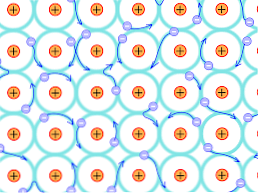
Teooria puudused
Metallide aatomites on väike kogus valentselektroone proportsionaalselt nende energiakogustega; see tähendab, et on olemas suurem hulk olemasolevaid energia olekuid kui ühendatud elektronide hulk.
See tähendab, et seal on tugev elektronide delokaliseerimisele ja energia ansamblid, mis on täidetud osaliselt, elektronid võivad liikuda võrestruktuuris kui neile on elektrivälja väljastpoolt peale moodustavad ookeani elektronide mis toetab võrgu läbilaskvust.
Nii tõlgendatakse metallide liit kui positiivselt laetud ioonide konglomeraat, mis on ühendatud elektronide merega (negatiivselt laetud)..
Siiski on selliseid omadusi, mida see mudel ei selgita, näiteks teatud sulamite moodustumine metallide ja spetsiifiliste kompositsioonide vahel või kollektiivsete metallühenduste stabiilsus..
Need puudused on seletatav kvantmehaanika, sest nii see teooria paljud muud võimalused on loodud põhineb lihtsaim mudel ühe elektroni, püüdes lähtutakse keerukamate struktuuride multielectron aatomit.
Viited
- Wikipedia. (2018). Wikipedia. Välja otsitud aadressilt en.wikipedia.org
- Holman, J. S. ja Stone, P. (2001). Keemia Välja otsitud aadressilt books.google.co.ve
- Parkin, G. (2010). Metall-metalli liimimine. Välja otsitud aadressilt books.google.co.ve
- Rohrer, G. S. (2001). Kristalliliste materjalide struktuur ja liimimine. Välja otsitud aadressilt books.google.co.ve
- Ibach, H. ja Lüth, H. (2009). Tahkis-füüsika: Sissejuhatus materjaliteaduse põhimõtetesse. Välja otsitud aadressilt books.google.co.ve


