Alumiiniumsulfaat (Al2 (SO4) 3) struktuur, kasutusalad, tüübid, toksilisus
The alumiiniumsulfaat on anorgaaniline alumiiniumisool valemiga Al2(SO4)3, mis on tavaliselt valge tahke kristallidega. Ühendi värvi mõjutab selle raua kontsentratsioon ja mis tahes muu lisand. Alumiiniumsulfaati on kahte tüüpi: A ja B.
Alumisel pildil on kujutatud hüdraaditud alumiiniumsulfaadi valgeid kristalle. Märkida võib pruunide värvuste puudumist, mis viitab raua ioonidele kristalse võre sees.

Alumiiniumsulfaat on sool, mis on vees väga hästi lahustuv ja looduses on seda harva veevaba. See on tavaliselt hüdraatunud oktadekahüdraadi alumiiniumsulfaadi kujul [Al2(SO4)3.18H2O] või heksadekahüdraat [Al2(SO4)3.16H2O].
Samamoodi võib see moodustada kaaliumi ja ammooniumi, alumina tuntud ühendite, kahesoola soola. Osaliselt võib see olla tingitud vee afiinsusest hüdraatides, et hoida alumiiniumi kõrval teisi ioone.
Alumiiniumsulfaati võib lagundada vee toimel alumiiniumhüdroksiidis ja väävelhappes. See omadus on võimaldanud selle kasutamist mulla hapestajana.
See on ka toksiline ühend, eriti kokkupuutel pulbriga. Siiski on sellel äärmiselt vähe kasutusviise ja rakendusi, mis ulatuvad vee puhastamisest koagulatsioonimeetodi abil, kasutades selle kasutamist mitmes tööstusharus, kuni selle kasutamine terapeutiliste eesmärkidega.
Indeks
- 1 Struktuur
- 2 Mis see on (kasutusalad)
- 2.1 Vee koagulatsioon või flokulatsioon
- 2.2 Kasutage tindina ja paberi väljatöötamisel
- 2.3 Tööstuslik kasutamine
- 2.4 Ravi- ja raviotstarbelised kasutused
- 2.5 Muud kasutusalad
- 3 Alumiiniumsulfaadi tootmine
- 4 tüübid
- 5 Toksilisus
- 6 Viited
Struktuur
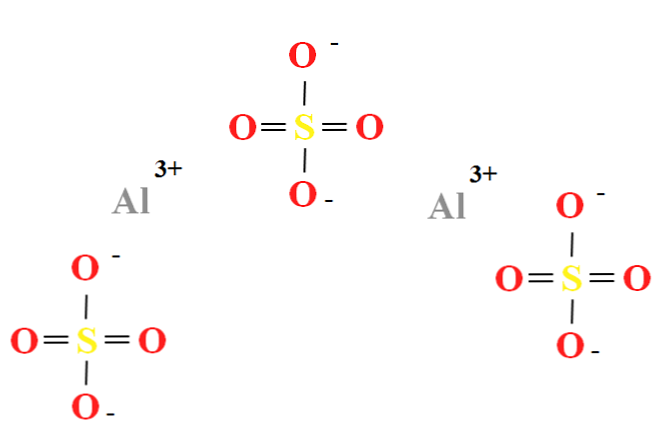
Alumiiniumsulfaadil on kahe kationi suhe3+ iga kolme aniooni SO kohta42- (ülemine pilt), mida saab jälgida otse selle keemilises valemis Al2(SO4)3.
Pange tähele, et Al3+ need on hallid, samas kui vastuväide42- need on kollased (väävliaatomi puhul) ja punased (hapniku aatomite puhul).
Illustreeritud struktuur vastab Al veevaba vormile2(SO4)3, kuna ükski veemolekul ei mõjuta ioonidega. Teie hüdraatides võib vett siiski meelitada Al-positiivsetesse keskustesse3+, või negatiivse SO tetraeedriga42- läbi vesiniksidemete (HOH-O-SO32-).
Al2(SO4)3∙ 18H2Või näiteks sisaldab see tahket struktuuri 18 veemolekuli. Mõned neist võivad olla Aliga otseses kontaktis3+ või vastuväidetega42-. Teisisõnu: alumiiniumsulfaat võib sisaldada sisemist või välist koordineerivat vett.
Samuti võib selle struktuur sisaldada teisi katioone nagu Fe3+, Na+, K+, jne Kuid selleks on vajalik rohkem anioonide SO olemasolu42-. Mida? Metallide lisanditest tulenevate positiivsete tasude suurenemise neutraliseerimine.
Alumiiniumsulfaadil võib olla palju struktuure, kuigi selle hüdraadid kalduvad kasutama monokliinilist kristalset süsteemi.
Füüsikalised ja keemilised omadused
Välimus
See on tahkete valge kristallide, graanulite või pulbri kujul.
Molekulmass
342,31 g / mol (veevaba).
Lõhn
See on lõhnatu
Maitse
Magus maitse mõõdukalt kokkutõmbav.
Sulamistemperatuur
770 ° C veevaba vorm (86,5ºC oktadekahidratadivorm)
Lahustuvus vees
31,2 g / 100 ml 0 ° C juures; 36,4 g / 100 ml temperatuuril 20 ° C ja 89 g / 100 ml 100 ° C juures.
Tihedus
2,67-2,71 g / cm3.
Lahustuvus
Etüülalkoholis lahustub veidi.
Aururõhk
Sisuliselt null.
Stabiilsus
Stabiilne õhus.
Lagunemine
Kuumutamisel, ligikaudu selle sulamistemperatuuril, võib see laguneda, tekitades eriti vääveloksiidi, mürgist gaasi.
Söövitavus
Alumiiniumsulfaadi lahused on söövitavad alumiiniumi. Samuti võib ühend niiskuse juuresolekul metalle korrodeerida.
pKa
3.3 kuni 3.6. Ja selle pH on 2,9 või enam 5% vesilahuses.
Mis see on (kasutusalad)
Vee koagulatsioon või flokulatsioon
-Vee segamisel (joogi-, serveerimis- või jäätmekäitlus) põhjustab alumiiniumsulfaat alumiiniumhüdroksiidi, mis moodustab komplekse lahuses sisalduvate ühendite ja osakestega, kiirendades nende settimist, mis alumiiniumsulfaadiga töötlemise puudumisel võtaks pikka aega.
-Alumiiniumsulfaati kasutatakse ka basseini vee puhastamiseks, muutes need atraktiivsemaks kasutamiseks.
-Alumiiniumsulfaadi kasutamisega saadakse vett ilma hägususe ja värvita, suurendades vee joogiväärtust, hõlbustades vee puhastamist. Kahjuks võib see puhastamismeetod põhjustada vees alumiiniumi veidi suurenenud kontsentratsiooni.
-Alumiinium on väga mürgine metall, mis koguneb nahka, ajusse ja kopsudesse ning põhjustab tõsiseid häireid. Lisaks ei ole teada, millist funktsiooni ta täidab elusolendites.
-Euroopa Liit nõuab, et alumiiniumi maksimaalne lubatud piirväärtus vees ei ületaks 0,2 mg / l. Vahepeal nõuab USA keskkonnakaitseagentuur, et alumiiniumi maksimaalne veereostuspiir ei ületaks 0,05-0,2 mg / l.
-Heitvee töötlemine või alumiinium-sulfaadiga töötlemine võimaldab nende fosfori kõrvaldamist või vähendamist majanduslikult.
Kasutage trükivärvidena ja paberi väljatöötamisel
-Alumiiniumsulfaati on kasutatud värvainetena või tindidena, aidates kinnitada värvitavale materjalile. Selle kinnitamise põhjuseks on Al (OH)3, mille želatiiniline konsistents aitab kaasa värvainete adsorptsioonile tekstiilidele.
-Kuigi seda on kasutatud alates 2000. aastast eKr. Kirjeldatud eesmärgil, on ainult orgaanilised värvained nõutavad. Seevastu sünteetilised värvained ei nõua, et pihustid täidaksid oma funktsiooni.
-See on paberitootmisest eemaldatud, kuid seda kasutatakse paberimassi tootmisel. Eemaldab lisandid, samuti on kasutatud materjalide sidumiseks, neutraliseerivad laengud ja kalibreerima kampoli.
Tööstuslik kasutamine
-Seda kasutatakse ehituses, et kiirendada betooni seadistamist. Lisaks kasutatakse seda hoonete hüdroisolatsiooniks.
-Seebi- ja rasvatööstuses kasutatakse seda glütseriini tootmisel.
-Seda kasutatakse naftatööstuses töötamisel kasutatavate sünteetiliste katalüsaatorite valmistamisel.
-Seda kasutatakse farmaatsiatööstuses ravimite ja kosmeetikatoodete valmistamisel.
-Vahendid värvide nagu karmiini tootmisel. Seda kasutatakse ka värvainena butadieenstüreeni sünteetiliste kummide valmistamisel.
-Suhkrutööstuses kasutatakse seda suhkrurooga melassi puhastajana.
-Seda kasutatakse deodorantide tootmisel. Miks? Kuna see põhjustab higinäärmete kanalite ahenemist, piirates seega higi kogunemist, on vajalik vahend lõhna põhjustavate bakterite kasvuks..
-Seda kasutatakse naha parkimisel, selle kasutamiseks vajaliku protsessina. Lisaks kasutatakse seda väetiste valmistamisel.
-Seda kasutatakse lisandina värvide, liimide ja hermeetikute, samuti mööbli puhastus- ja hooldustoodete valmistamisel..
Ravi- ja raviotstarbelised kasutused
-Alumiiniumsulfaat on immunoloogiline adjuvant. Seetõttu täidab ta antigeenide töötlemise funktsiooni selliselt, et nende toimekohas vabanemisel tekitaksid nad suuremate antikehade tootmise inokuleeritud antigeenide jaoks..
-Freundi adjuvant ja BCG, samuti teised adjuvandid, kaasa arvatud endogeensed, nagu näiteks interleukiinid, on antigeenide suhtes mittespetsiifilised, võimaldades immuunsuse raadiuse suurenemist. See on võimaldanud paljude haiguste vastu vaktsineerida.
-Alumiiniumsulfaadi koaguleeriv toime on võimaldanud mitmete viiruste kõrvaldamist töödeldud vees, muu hulgas: Q beeta, MS2, T4 ja P1. Tulemused näitavad, et vee töötlemine alumiiniumsulfaadiga tekitab selliste viiruste inaktiveerimise.
-Alumiiniumsulfaati kasutatakse paelana või pulbrina väikeste pindmiste haavade või hõõrdumise korral, mis tekivad raseerimisel.
-Seda kasutatakse alumiiniumatsetaadi valmistamiseks, mida kasutatakse mõne kõrva seisundi raviks. Seda on kasutatud ka ilma märkimisväärse eduta, et leevendada tulekahju hammustuste tagajärgi..
-Alumiiniumsulfaadi lahuseid kasutatakse kontsentratsioonil 5% kuni 10% haavandite lokaalses ravis, mis võimaldab nende sekretsioone kontrollida..
-Alumiiniumsulfaadi kokkutõmbav toime on naha pindmiste kihtidega kokku lepitud, valkude koagulatsioon ja haavade paranemine.
Muud kasutusalad
-Alumiiniumsulfaat aitab kontrollida vetikate liigset kasvu tiikides, järvedes ja veevoogudes. Seda kasutatakse ka molluskide eemaldamiseks, muu hulgas ka Hispaania nälkjas.
-Aednikud kasutavad seda ühendit aluseliste muldade hapestamiseks. Kokkupuutel selle veega laguneb alumiiniumsulfaat alumiiniumhüdroksiidiks ja lahjendatud väävelhappeks. Seejärel sadestub alumiiniumhüdroksiid, jättes väävelhappe lahusesse.
-Väävelhappest tingitud muldade hapestumine visualiseeritakse väga loomingulisel viisil, kuna on olemas taim, mida nimetatakse Hortensiaks, mille lilled muutuvad happelise pinnase juuresolekul siniseks; see tähendab, et nad on tundlikud ja reageerivad pH muutustele.
-Tulekahju tõkestamiseks ja kontrollimiseks on vahtu tootmisel kaasatud alumiiniumsulfaat. Kuidas? Reageerib naatriumvesinikkarbonaadiga, tekitades CO vabanemise2. See gaas blokeerib O-juurdepääsu2 materjali põlemiskohale; ning sellest tulenevalt ka relvarahu.
Alumiiniumsulfaadi tootmine
Alumiiniumsulfaat sünteesitakse alumiiniumirikka ühendi, näiteks boksiidi maagi, reageerimisel väävelhappega kõrgendatud temperatuuridel. Järgnev keemiline võrrand esindab reaktsiooni:
Al2O3 + H2SO4 -> Al2(SO4)3 + 3 H2O
Alumiiniumsulfaati võib valmistada ka neutraliseerimisreaktsiooniga alumiiniumhüdroksiidi ja väävelhappe vahel vastavalt järgmisele reaktsioonile:
2 Al (OH)3 + 3 H2SO4 + 12 H2O -> Al2(SO4)3.18H2O
Väävelhape reageerib alumiiniumiga, moodustades ammooniumsulfaadi ja vabastades vesiniku molekulid gaasi kujul. Reaktsioon on skemaatiliselt järgmine:
2 Al + 3 H2SO4 -> Al2(SO4)3 + 3 H2
Tüübid
Alumiiniumsulfaat liigitatakse kahte tüüpi: A-tüüpi ja B-tüüpi. A-tüüpi alumiiniumsulfaadis on tahked ained valged ja nende rauasisaldus on alla 0,5%..
B-tüüpi alumiiniumsulfaadis on tahked ained pruunid ja nende raua kontsentratsioon on alla 1,5%..
On tööstusi, mis toodavad alumiiniumsulfaati, millel on nende klassifitseerimiseks erinevad kriteeriumid. Seega annab tööstus aru A-tüüpi alumiiniumsulfaadi valmistamise kohta, mille maksimaalne kontsentratsioon raudaoksiidina on 0,1%. B-tüübi puhul näitavad need maksimaalset rauasisaldust 0,35%..
Toksilisus
-Alumiiniumsulfaat on ühend, mis avaldab toksilist toimet kokkupuutel tolmuga, põhjustades nahaärritust ja juhtudel, kui kokkupuude on sagedane, dermatiit..
-Silmas põhjustab see tugevat ärritust isegi püsivate vigastuste tekitamiseks.
-Sissehingamine põhjustab nina ja kurgu ärritust, mis võib põhjustada köha ja löövet.
-Selle tarbimine põhjustab maoärritust, iiveldust ja oksendamist.
-On toksilisi mõjusid, et kuigi need ei ole otseselt alumiiniumsulfaadi tõttu, on need kaudselt nende kasutamise tõttu. See on alumiiniumi teatud toksilise mõju puhul, mis on tingitud alumiiniumsulfaadi kasutamisest vee puhastamisel.
-Patsientidel, keda on krooniliselt dialüüsitud, kasutades puhastatud vees valmistatud sooli, kasutades alumiiniumsulfaati, esineb väga tõsiseid tervisehäireid. Nende haiguste hulgas on aneemia, dialüüsravi ja luuhaiguste suurenemine.
Viited
- Wikipedia. (2018). Alumiiniumsulfaat Vastu võetud: en.wikipedia.org
- Aris Industrial A ja B tüüpi alumiiniumsulfaadi lahus. Võetud: aris.com.pe
- Christopher Boyd (9. juuni 2014). Alumiiniumsulfaadi parimad tööstuslikud kasutused. Välja võetud: chemservice.com
- PubChem. (2018). Veevaba alumiiniumsulfaat. Välja võetud: pubchem.ncbi.nlm.nih.gov
- Andesia Chemicals (20. august 2009). Alumiiniumsulfaadi ohutusleht. [PDF] Välja võetud: andesia.com
- Keemiline raamat. (2017). Alumiiniumsulfaat. Välja võetud: chemicalbook.com


