Propüleeni keemiline struktuur, omadused ja kasutusalad
The propüleen või propeen toatemperatuuril ja atmosfäärirõhul on gaasilises olekus ja nagu teised alkeenid, on värvitu. Sellel on õli sarnane lõhn, kuid vähem intensiivne. Sellel on dipoolmoment, kuna kuigi sellel puudub tugev polaarne ühendus, on selle molekul asümmeetriline.
Samuti on propüleen tsüklopropaani struktuurne isomeer (neil on sama keemiline valem C)3H6). See esineb looduses taimestiku ja käärimisprotsesside tagajärjel. Tehislikult tekib fossiilkütuste, näiteks nafta, maagaasi ja vähemal määral süsiniku töötlemisel.

Samamoodi on etüleen ja propüleen nafta rafineerimise saadused suurte süsivesinike molekulide lõhustamisel väikeste süsivesinike tekitamiseks suure nõudlusega..
Propüleeni võib saada ka erinevate meetodite abil:
- Reageerides pöörduvalt etüleeni ja buteeniga, kus kaksiksidemed on katkenud ja formuleeritud, et saada propüleen.
- Propaani dehüdrogeenimise (vesiniku kadu) kaudu.
- Osana metanoolist (MTO) pärit olefiinide tootmise programmist toodeti propüleeni metanoolist. See juhiti läbi tseoliidi katalüsaatori, mis soodustab selle dehüdratsiooni ja viib etüleeni ja propüleeni moodustumiseni..
3CH3OH (metanool) => CH3CH = CH2 (propüleen) + 3H2O (vesi)
Indeks
- 1 Keemiline struktuur
- 2 Atribuudid
- 2.1 Molekulmass
- 2.2 Keemistemperatuur
- 2.3 Sulamistemperatuur
- 2.4 Leekpunkt
- 2.5 Lahustuvus
- 2.6 Lahustuvus väljendatuna massina
- 2.7 Tihedus
- 2.8 Auru tihedus
- 2.9 Aururõhk
- 2.10 Autoignitsioon
- 2.11 Viskoossus
- 2.12 Põlemissoojus
- 2.13 Aurustumistemperatuur
- 2.14 Pinna pinge
- 2.15 Polümerisatsioon
- 2.16 Külmutuspunkt
- 2.17 Lõhnalävi
- 3 Kasutamine
- 3.1 Polüpropüleen
- 3.2 Akrüülnitriil
- 3.3 Propüleenoksiid
- 3.4 Alkoholide ja muude kasutuste sünteesimiseks
- 4 Viited
Keemiline struktuur
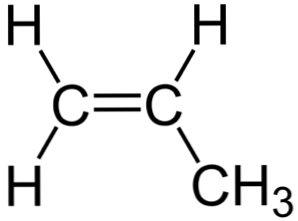
Ülaltoodud pildil võib näha propüleeni keemilist struktuuri, kus selle asümmeetria paistab (parem pool on vasakul). Selle süsinikukarketti, mis ei sisalda H-aatomeid, võib täheldada bumerangina.
See bumerang esitab ühe külje küllastumata või kaksiksideme (C)1) ja seetõttu on see sp hübridisatsiooni tõttu tasane2 süsinikuaatomite hulgast.
Kuid teisel poolel on metüülrühm (-CH3), mille hübridisatsioon on sp3 ja tal on tetraedriline geomeetria. Seega on bumerang vaadatuna esiküljelt tasane, kusjuures H-aatomid ulatuvad sellest 109,5º juures.
Gaasifaasis reageerib molekul koos teiste dispersioonijõududega nõrgalt. Ka metüülrühm takistab kahe propüleeni molekuli kaksiksidemete (π-π) vahelisi koostoimeid.
Selle tulemuseks on nende molekulidevaheliste jõudude vähenemine, mis kajastub nende füüsikalistes omadustes. Ainult väga madalatel temperatuuridel võib propüleen omada tahket struktuuri, milles bumeraan jääb nende nõrkade koostoimetega rühmitatuks.
Omadused
See on aromaatse lõhnaga värvitu gaas. Seda transporditakse veeldatud gaasi kujul ja kui see väljub mahutitest, mis seda sisaldavad, siis see toimub gaasi või vedeliku kujul. Madalates kontsentratsioonides moodustab see õhuga plahvatusohtliku ja tuleohtliku segu, mille propüleeni tihedus on õhust kõrgem.
Molekulmass
42,081 g / mol
Keemistemperatuur
53,9 ° F kuni 760 mmHg
48 ° C kuni 760 mmHg
Sulamistemperatuur
301,4 ° F
185 ° C
Leekpunkt
162 ° F
Lahustuvus
44,6 ml / 100 ml vees.
1 250 ml / 100 ml etanoolis.
524,5 ml / 100 ml äädikhappes.
Lahustuvus väljendatakse massina
200 mg / l 25 ° C
Tihedus
0,609 mg / ml -52,6 ° F juures
0,5139 temperatuuril 20 ° C
Auru tihedus
1,46 kuni 32 ° F (võrdluseks kasutatava õhu suhtes).
1,49 (õhk = 1).
1,91 kg / m3 kuni 273,15 ° K
Aururõhk
1 mmHg temperatuuril -205,4ºF
760 mmHg kuni -53.9 ° F
8,69 × 103 mmHg 25 ° C juures (ekstrapoleeritud väärtus).
1,158 kPa temperatuuril 25 ° C
15,4 atm temperatuuril 37 ° C
Autoignitsioon
851 ° F
455 ° C
Viskoossus
83,4 mikropikkus 16,7 ° C juures.
Põlemise soojus
16 692 BTU / lb
10,940 cal / g
Aurustumistemperatuur
104,62 cal / g (keemistemperatuuril)
Pinna pinge
16,7 dün / cm 90 ° C juures
Polümerisatsioon
Polümeriseeritakse kõrgetel temperatuuridel ja kõrgel rõhul katalüsaatorite juuresolekul.
Külmutuspunkt
185,25 ° C.
Lõhnalävi
10-50 mg / m3 (tuvastamine)
100 mg / m3 (tunnustamine)
Kasutamine

Seda kasutatakse naftakeemiatööstuses kütuse ja alküüliva ainena. Keemiatööstuses kasutatakse seda paljude derivaatide tootmise ja sünteesi toorainena.
See on kasulik peamiselt polüpropüleeni, akrüülnitriili (ACN), propüleenoksiidi (PO), alkoholi, kumeeni ja akrüülhapete tootmisel.
Polüpropüleen
Polüpropüleen on üks peamisi plastmaterjale, mida kasutatakse elektroonikaseadmetes ja elektriseadmetes, majapidamises, pudelikorgides ja kohvrites.
Lamineeritud materjali kasutatakse maiustuste, etikettide, CD-de jne pakendamisel, kuid kiud on valmistatud kaustadest ja riidest..
Akrüülnitriil
Elastomeersed polümeerid ja kiud saadakse akrüülnitriilis. Need kiud on mõeldud eri rõivaste valmistamiseks, näiteks kampsunid, sokid ja spordirõivad. Neid kasutatakse ka kodumööblis, kaustades, polsterduses, padjades ja tekkides.
Propüleenoksiid
Propüleenoksiid osaleb polüuretaani sünteesi komponendina. Seda kasutatakse painduva vahu ja jäiga vahu valmistamiseks. Painduvat vahtu kasutatakse kodumööbli ja autotööstuse täiteainena.
Teisest küljest kasutatakse jäigast vahtu peamiselt ehitiste isolatsioonimaterjalina.
Lisaks kasutatakse propüleenoksiidi propüleenglükooli tootmisel. Seda ühendit kasutatakse küllastumata polüestervaigude valmistamisel ja antifriisina.
Lisaks kasutatakse propüleenoksiidi propüleenglükooli eetri valmistamiseks. See eeter on rakendatud värvide, rõivaste, trükivärvide, vaigude ja puhastusvahendite valmistamiseks.
Alkoholide ja muude kasutuste sünteesimiseks
Propüleen võimaldab saada mõned alkoholid, nende hulgas isopropanooli, mida kasutatakse kosmeetikas ja isikliku hügieeni toodetes lahustina. Lisaks täidab see antiseptilise toimeaine funktsiooni.
- Isopropanool on seotud värvide, vaigude, trükivärvide ja kleeplindide tootmisega. Seda kasutatakse ka farmaatsiatööstuses.
- Oksoalkoholi2-etüülheksanooli kasutatakse ftalaatide, plastifikaatorite, kleepainete ja värvide tootmiseks.
- Butanooli kasutatakse värvide, katete, vaigude, värvainete, ravimite ja polümeeride valmistamiseks.
Teisest küljest toodetakse kumeeni propüleeni ja benseeni kombinatsioonist. Kumeen on peamine ühend fenooli ja atsetooni valmistamisel, mida kasutatakse mitmesugustes toodetes, nagu polükarbonaadid, fenoolvaigud, epoksüvaigud ja metüülmetakrülaat..
Lõpuks kasutatakse akrüülhapet - teist toodet, mis on saadud propüleenist - akrüülestrite ja -vaikude tootmiseks värvide, katte- ja liimainetena..
Viited
- Michal Osmenda (26. detsember 2007). Kergesta mu tulekahju. [Joonis] Välja otsitud 23. mail 2018 alates: commons.wikimedia.org
- Linde grupp. (2018). Propüleen Välja otsitud 23. mail 2018 kellelt: linde-gas.com
- Wikipedia. (2018). Propeen Välja otsitud 23. mail 2018 kellelt: en.wikipedia.org
- PubChem. (2018). Propüleen Välja otsitud 27. mail 2018 kellelt: pubchem.ncbi.nlm.nih.gov
- Vesovic Velisa. (7. veebruar 2011). Propüleen Välja otsitud 27. mail 2018 alates: thermopedia.com
- Jeffrey S. Plotkin. (8. august 2016). Propüleenkvantary. Välja otsitud 27. mail 2018 kellelt: acs.org
- ICIS. (6. november 2017). Propüleeni kasutamine ja turuandmed. Välja otsitud 27. mail 2018 alates: icis.com


