Ammooniumhüdroksiidi struktuur, omadused, nomenklatuur, kasutusalad
The ammooniumhüdroksiid on NH molekulaarse valemiga ühend4OH või H5MITTE toodetud ammoniaagigaasi (NH) lahustamisega3) vees. Sel põhjusel saab ta ammoniaagi või vedela ammoniaagi nimed.
See on värvitu vedelik väga intensiivse ja terava lõhnaga, mis ei ole isoleeriv. Neil omadustel on otsene seos NH kontsentratsiooniga3 lahustatud vees; kontsentratsioon, mis tegelikult gaasina võib katta suurtes kogustes väikestes kogustes vett.
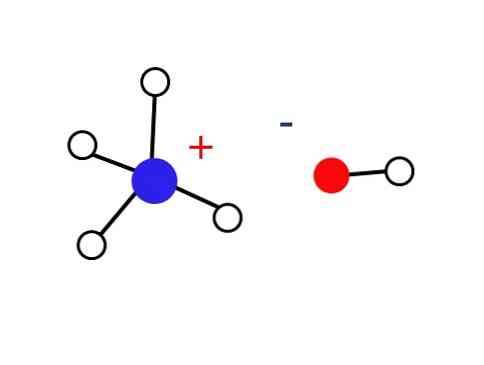
Märkimisväärselt väike osa nendest vesilahustest koosneb NH katioonidest4+ ja OH anioonid-. Teisest küljest võib väga lahjendatud lahustes või külmutatud tahkistes väga madalatel temperatuuridel leida ammoniaaki hüdraatide kujul, näiteks: NH3∙ H2O, 2NH3∙ H2O ja NH3∙ 2H2O.
Uudishimulikult on Jupiteri pilved moodustatud ammooniumhüdroksiidi lahjendatud lahustest. Siiski ei suutnud Galileo kosmosesond leida planeedi pilvedes vett, mida eeldatakse teadmisest, et ammooniumhüdroksiidi moodustumine on teada; see tähendab, et need on NH-kristallid4OH täiesti veevaba.
Ammooniumioon (NH4+) toodetakse neerutorukeste luumenis ammoniaagi ja vesiniku liitumise kaudu, mida eritavad neerutorukeste rakud. Samamoodi toodetakse ammoonium tubulaarsetes rakkudes glutamiini muundamisel glutamaadiks ja omakorda glutamaadi muundamisel a-ketoglutaraadiks.
Ammoniaak toodetakse tööstuslikult Haber-Boschi meetodil, milles reageeritakse lämmastiku- ja vesinikgaasid; katalüsaatoritena kasutatakse raudiooni, alumiiniumoksiidi ja kaaliumoksiidi. Reaktsioon viiakse läbi kõrgel rõhul (150 - 300 atmosfääri) ja kõrgetel temperatuuridel (400-500 ° C) saagisega 10-20%..
Reaktsioonis toodetakse ammoniaaki, mis oksüdeerimisel tekitab nitriteid ja nitraate. Need on olulised lämmastikhappe ja väetiste, näiteks ammooniumnitraadi saamiseks.
Indeks
- 1 Keemiline struktuur
- 1.1 Ammoniaagi jää
- 2 Füüsikalised ja keemilised omadused
- 2.1 Molekulaarne valem
- 2.2 Molekulmass
- 2.3 Välimus
- 2.4 Kontsentratsioon
- 2.5 Lõhn
- 2.6 Maitse
- 2.7 Läviväärtus
- 2.8 Keemispunkt
- 2.9 Lahustuvus
- 2.10 Lahustuvus vees
- 2.11 Tihedus
- 2.12 Auru tihedus
- 2.13 Aururõhk
- 2.14 Söövitav toime
- 2,15 pH
- 2.16 Dissotsiatsioonikonstant
- 3 Nomenklatuur
- 4 Lahustuvus
- 5 Riskid
- 5.1 Reaktsioonivõime
- 6 Kasutamine
- 6.1 Toidus
- 6.2 Terapeutika
- 6.3 Tööstuslikud ja mitmesugused
- 6.4 Põllumajanduses
- 7 Viited
Keemiline struktuur
Nagu on määratletud selle määratluses, koosneb ammooniumhüdroksiid ammoniaagi gaasi vesilahusest. Seega ei ole vedelikus mingit muud struktuuri kui NH-ioonide juhuslikus paigutus4+ ja OH- vee molekulidega.
Ammoonium- ja hüdroksüülioonid on ammoniaagi hüdrolüüsi tasakaalu tooted, mistõttu on tavaline, et nendel lahustel on terav lõhn:
NH3(g) + H2O (l) <=> NH4+(ac) + OH-(ac)
Vastavalt keemilisele võrrandile nihutaks vee kontsentratsiooni suur vähenemine tasakaalu rohkem ammoniaagi moodustumiseni; see tähendab, et ammooniumhüdroksiidi kuumutamisel vabaneb ammoniaagi aur.
Seetõttu on NH ioonid4+ ja OH- nad ei suuda maapealsetes tingimustes kristalli moodustada, mis toob kaasa nii, et tahke alus NH4OH ei ole olemas.
See tahke aine peaks koosnema ainult nendest ioonidest, mis interakteeruvad elektrostaatiliselt (nagu on näidatud joonisel)..
Ammoniaagi jää
Kuid temperatuuridel, mis on tunduvalt alla 0 ° C ja mida ümbritsevad tohutud rõhud, nagu need, mis valitsevad jäiste kuude tuumades, ammoniaak ja vee külmutamine. Seejuures kristalliseeruvad nad tahkes segus erinevate stöhhiomeetriliste proportsioonidega, olles lihtsaim NH3∙ H2O: ammoniaagi monohüdraat.
NH3∙ H2O ja NH3∙ 2H2Või nad on ammooniumjää, sest tahke aine koosneb vesimolekulide ja vesiniksidemetega ühendatud ammoniaagi kristalsest paigutusest.
Arvestades T- ja P-i muutust, on arvutuslike uuringute kohaselt, mis simuleerivad kõiki füüsilisi muutujaid ja nende mõju nendele jäädele, toimub NH-faasi üleminek.3∙ nH2Või NH-faasi4OH.
Seega ainult NH äärmuslikes tingimustes4OH võib esineda NH-i jäälises protoonimisproduktis3 ja H2O:
NH3(s) + H2O (s) <=> NH4OH (d)
Pange tähele, et seekord, erinevalt ammoniaagi hüdrolüüsist, on asjaomased liigid tahkes faasis. Ammoniaagi jää, mis muutub soolaks ilma ammoniaagi vabastamata.
Füüsikalised ja keemilised omadused
Molekulaarne valem
NH4OH või H5EI
Molekulmass
35,046 g / mol
Välimus
See on värvitu vedelik.
Kontsentratsioon
Kuni umbes 30% (NH ioonide puhul)4+ ja OH-).
Lõhn
Väga tugev ja terav.
Maitse
Acre.
Läviväärtus
34 ppm mittespetsiifiliseks avastamiseks.
Keemistemperatuur
38 ° C (25%).
Lahustuvus
See eksisteerib ainult vesilahuses.
Lahustuvus vees
Seguneb piiramatutes proportsioonides.
Tihedus
0,90 g / cm3 temperatuuril 25 ° C.
Auru tihedus
Võrreldes ühikuna võetud õhuga: 0.6. See tähendab, et see on õhust väiksem. Kuid loogiliselt vastab esitatud väärtus ammoniaagile kui gaasile, mitte selle vesilahustele või NH-le4OH.
Aururõhk
2.160 mmHg temperatuuril 25 ° C.
Sööbiv toime
See on võimeline tsinki ja vaske lahustama.
pH
11,6 (lahus 1 N); 11,1 (lahus 0,1 N) ja 10,6 (0,01 N lahus).
Dissotsiatsioonikonstant
pKb = 4,767; Kb = 1,71 x 10-5 temperatuuril 20 ° C
pKb = 4,751; Kb = 1,774 x 10-5 temperatuuril 25 ° C.
Temperatuuri tõus tõuseb ammendavalt ammooniumhüdroksiidi aluselist alust.
Nomenklatuur
Millised on kõik tavalised ja ametlikud nimed, mida NH saab?4OH? Vastavalt IUPACi määratlusele on selle nimi ammooniumhüdroksiid, kuna see sisaldab hüdroksüülaniooni.
Ammoonium oma koormuse +1 järgi on monovalentne, põhjus, miks nomenklatuuri kasutamine on nimega: ammooniumhüdroksiid (I).
Kuigi mõiste "ammooniumhüdroksiid" kasutamine on tehniliselt vale, kuna ühend ei ole isoleeritav (vähemalt mitte Maal, nagu on üksikasjalikult kirjeldatud esimeses osas)..
Lisaks sellele saadakse ammooniumhüdroksiid ammoniaagi ja vedela ammoniaagi nimed.
Lahustuvus
NH4OH, kuna maapinnal ei ole soola, ei saa hinnata, kui lahustuv on erinevates lahustites.
Siiski võib eeldada, et see on vees väga hästi lahustuv, kuna selle lahustumine vabastaks tohutuid koguseid NH-i3. Teoreetiliselt oleks see hämmastav viis ammoniaagi säilitamiseks ja transportimiseks.
Teistes lahustites, mis on võimelised vastu võtma vesiniksidemeid, nagu alkoholid ja amiinid, võib eeldada, et see oleks ka nendes hästi lahustuv. Siin NH-katioon4+ on vesiniku sildade doonor ja OH- see toimib nagu mõlemad.
Nende interaktsioonide näited metanooliga oleksid: H3N+-H - OHCH3 ja HO- - HOCH3 (OHCH3 näitab, et hapnik saab vesiniksideme, mitte et metüülrühm on seotud H-ga).
Riskid
-Silma sattumisel põhjustab ärritust, mis võib põhjustada silmakahjustusi.
-See on söövitav. Seetõttu võib nahaga kokkupuutel põhjustada ärritust ja reaktiivi kõrge kontsentratsiooni korral nahapõletusi. Ammooniumhüdroksiidi korduv kokkupuude nahaga võib põhjustada selle kuivust, sügelust ja punetust (dermatiit)..
-Ammooniumhüdroksiidi pihusti sissehingamine võib põhjustada hingamisteede ägeda ärrituse, mida iseloomustab lämbumine, köha või õhupuudus. Aine pikaajaline või korduv kokkupuude võib põhjustada korduvaid bronhide infektsioone. Samuti võib ammooniumhüdroksiidi sissehingamine põhjustada kopsude ärritust.
-Ammooniumhüdroksiidi suurte kontsentratsioonidega kokkupuude võib olla meditsiiniline hädaolukord, sest võib tekkida vedeliku akumulatsioon kopsudes (kopsuturse)..
-Kaheksa tunni pikkuse vahetuse ajal on kokkupuute piirväärtuseks 25 ppm kontsentratsioon keskkonnas, kus töötaja puutub kokku ammooniumhüdroksiidi kahjuliku toimega..
Reaktsioonivõime
-Lisaks sellele on ammooniumhüdroksiidiga kokkupuutest tuleneva võimaliku tervisekahjustuse korral muid ettevaatusabinõusid, mida tuleb ainega töötamisel arvesse võtta..
-Ammooniumhüdroksiid võib reageerida paljude metallidega, nagu näiteks hõbe, vask, plii ja tsink. Samuti reageerib see nende metallide sooladega, moodustades plahvatusohtlikke ühendeid ja vabastades vesiniku; mis on omakorda tuleohtlik ja plahvatusohtlik.
-See võib tugevalt reageerida tugevate hapetega, näiteks vesinikkloriidhappega, väävelhappega ja lämmastikhappega. Samamoodi reageerib ta dimetüülsulfaadi ja halogeenidega.
-Reageerib koos tugeva alusega, nagu naatriumhüdroksiid ja kaaliumhüdroksiid, tekitades gaasilist ammoniaaki. Seda saab kontrollida, kui täheldatakse tasakaalu lahuses, kus OH ioonide lisamine- nihutab tasakaalu NH-i moodustumiseni3.
-Ammooniumhüdroksiidi käitlemisel ei tohiks vask- ja alumiiniummetalle, samuti teisi galvaniseeritud metalle kasutada, kuna need on söövitavad..
Kasutamine
Toidus
-Seda kasutatakse lisandina paljudes toiduainetes, kus see toimib toidupinna hapendamisvahendina, pH reguleerimisel ja viimistlusainena..
-Toiduaineid, milles kasutatakse ammooniumhüdroksiidi, on laiaulatuslik ja see hõlmab küpsetisi, juustu, šokolaadi, kommi ja pudleid..
-FDA liigitab toidu töötlemiseks ammooniumhüdroksiidi ohutuks aineks tingimusel, et järgitakse kehtestatud standardeid.
-Lihatoodetes kasutatakse seda antimikroobse toimeainena, mis on võimeline kõrvaldama selliseid baktereid nagu E. coli, vähendades seda määratlemata tasemeni. Bakterid leiduvad veiste soolestikus, kohandudes happekeskkonnaga. Ammooniumhüdroksiid, pH reguleerimisel, takistab bakterite kasvu.
Therapeutics
-Ammooniumhüdroksiidil on mitu terapeutilist kasutamist, sealhulgas:
-10% lahust kasutatakse hingamisteede refleksi stimulaatorina
-Väliselt kasutatakse seda putukahammustuste ja hammustuste raviks. See toimib seedetrakti kui antatsiidi ja karminatiivse toimena, see tähendab gaaside kõrvaldamist.
Lisaks kasutatakse seda aktuaalse hõõrdetegurina ägeda ja kroonilise luu- ja lihaskonna valu jaoks. Ammooniumhüdroksiidi heal tasemel toime tagajärjel suureneb verevool, punetus ja ärritus..
Tööstuslikud ja mitmesugused
-See toimib NOx redutseerimisel (väga reaktiivsed gaasid nagu lämmastikoksiid (NO) ja lämmastikdioksiid (NO))2)) korstnate heitkoguste ja NOx vähendamise kohta korstnaheitmetes.
-Seda kasutatakse plastifikaatorina; Värvide lisand ja pindade töötlemine.
-See suurendab juuste poorsust, võimaldades pleki pigmentidel suuremat läbitungimist, mis tagab parema viimistluse.
-Ammooniumhüdroksiidi kasutatakse reovee puhastamisel antimikroobse toimeainena. Lisaks sekkub see klooramiini sünteesi. See aine täidab basseini vee puhastamisel funktsiooni, mis sarnaneb klooriga, mille eeliseks on vähem toksiline.
-Seda kasutatakse korrosiooni inhibiitorina õli rafineerimisprotsessis.
-Seda kasutatakse puhastusvahendina mitmesugustes tööstuslikes ja kaubanduslikes toodetes, mida kasutatakse mitmel pinnal, sealhulgas: roostevaba teras, portselan, klaas ja ahi.
-Lisaks kasutatakse seda detergentide, seebide, ravimite ja tintide tootmisel.
Põllumajanduses
Kuigi ammooniumhüdroksiid ei ole otseselt manustatud väetisena, täidab see funktsiooni. Ammoniaak toodetakse atmosfääri lämmastikust Haber-Boschi meetodil ja transporditakse külmutuspunkti allpool keemistemperatuuri (-33 ° C) selle kasutamiskohtadesse..
Survestatud ammoniaak süstitakse auru kujul pinnasesse, kus see reageerib viivitamatult edafiinse veega ja läbib ammooniumivormi (NH4+), mis jääb pinnase katioonivahetuskohtadesse. Lisaks toodetakse ammooniumhüdroksiidi. Need ühendid on lämmastikuallikas.
Koos fosfori ja kaaliumiga moodustab lämmastik taimede kasvuks vajalike peamiste toitainete triaadi.
Viited
- Ganong, W. F. (2002), Meditsiiniline füsioloogia. 19. väljaanne. Redaktsiooniline kaasaegne käsiraamat.
- A. D. Fortes, J. P. Brodholt, I. G. Wood ja L. Vocadlo. (2001). Ammoniaagi monohüdraadi (NH. \ T3∙ H2O) ja ammooniumhüdroksiidi (NH4OH). Ameerika füüsikainstituut. J. Chem. Phys., Kd 115, nr 15, 15.
- Helmenstine, Anne Marie, Ph.D. (6. veebruar 2017). Ammooniumhüdroksiidi faktid. Välja otsitud andmebaasist: thinkco.com
- Pochteca Group. (2015). Ammooniumhüdroksiid. pochteca.com.mx
- NJ Health (s.f.). Faktileht ohtlike ainete kohta: ammooniumhüdroksiid. [PDF] Välja otsitud andmebaasist: nj.gov
- Keemia õppija. (2018). Ammooniumhüdroksiid. Välja otsitud andmebaasist: chemistrylearner.com
- PubChem. (2018). Ammooniumhüdroksiid. Välja otsitud andmebaasist: pubchem.ncbi.nlm.nih.gov


