Naatriumhüdriidi (NaH) omadused, reaktiivsus, ohud ja kasutusalad
The naatriumhüdriid See on anorgaaniline ühend valemiga NaH. Tal on ioonside vahel naatriumi ja juuresolekul. Selle struktuur on esitatud joonisel 1 on tüüpilised soola- hüdriidid, tähendust, mis on sarnane generatsioon soola, mis sisaldab Na + ioonide ja H, erinevalt molekulaarsel hüdriidid nagu boor, metaan, ammoniaak ja vee.
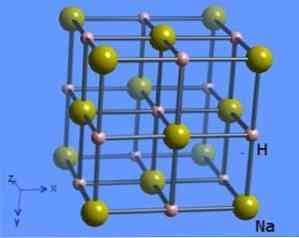
Kristallstruktuur koordinatsiooniarv 6, milles iga molekul on ümbritsetud naatriumhüdriid ioonid 8 esitades oktaeedrikujulise kuju ja on esitatud joonisel 2 (Mark Winter [University of Sheffield Ltd ja WebElements, 1993-2016).
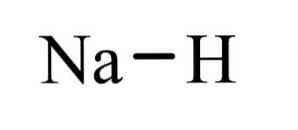
Ühend valmistatakse naatriumi ja vesiniku gaasi (naatriumhüdriidi valem - naatriumhüdriidi kasutamine, omadused, struktuur ja valem 2005-2017) vahelise otsese reaktsiooniga järgmiselt:
H2 + 2Na → 2NaH
Naatriumhüdriidi müüakse kaubanduslikult 60% (massi järgi) dispersioonivormis (massiprotsentides) mineraalõlis, mis on ohutuks kasutamiseks (SODIUM HYDRIDE, s.f.).
Indeks
- 1 Naatriumhüdriidi füüsikalised ja keemilised omadused
- 2 Reaktiivsus ja ohud
- 3 Kasutamine
- 4 Viited
Naatriumhüdriidi füüsikalised ja keemilised omadused
Naatriumhüdriid on valge tahke aine, kui see on puhas, kuigi tavaliselt saadakse see halli või hõbedaga. Selle välimus on näidatud joonisel 3.

NaH molekulmass on 23,99771 g / mol, tihedus 1,396 g / ml ja sulamistemperatuur 800 ° C (Royal Society of Chemistry, 2015). See ei lahustu ammoniaagis, benseenis, süsiniktetrakloriidis ja süsinikdisulfiidis (National Center for Biotechnology Information, s.f.).
Ühend on äärmiselt ebastabiilne. Puhas NaH võib kergesti õhus süttida. Kui see puutub kokku õhus oleva veega, vabastab see väga tuleohtlikku vesinikku.
Õhule ja niiskusele avatud NaH-ga hüdrolüüsitakse vastavalt reaktsioonile kergesti ka naatriumhüdroksiidi (NaOH) tugevaks söövitavaks aluseks.
NaH + H2O → NaOH + H2
Selles reaktsioonis võib täheldada, et naatriumhüdriid käitub nagu alus. See on tingitud elektronegatiivsusest.
Naatrium on elektronegatiivsus oluliselt madalam (≈1,0) kui vesinik (≈2,1), mis tähendab, et vesinik ekstraheeriti elektrontiheduse suunas ise ja sellest eemale naatriumi toota naatriumkatiooni ja aniooni generatsioon.
Et ühend oleks Brønstedi hape, peab see eraldama elektrontiheduse vesinikust, st ühendama selle elektronegatiivse aatomiga nagu hapnik, fluor, lämmastik jne. Alles siis saab seda ametlikult kirjeldada kui H + ja kas seda saab sellisena eraldada.
Hüdriidi kirjeldatakse palju paremini kui H- ja sellel on vaba elektronide paar. Sellisena on see Brønstedi alus, mitte hape. Tegelikult, kui pikendate Brønstedi happe / aluse määratlust nii, nagu Lewis seda tegi, jõuate järeldusele, et naatrium (Na +) on siin happeliigid.
H-aluse ja H + happe Brønstedi happe / aluse reaktsioonisaadus muutub H2-ks. Kuna happe vesinik ekstraheeritakse otse veest, võib vesinikgaas mulluda, tasakaalustades tasakaalu isegi siis, kui reaktsioon ei ole termodünaamiliselt eelistatav.
OH-ioone võib jätta, mida saab kirjutada ülejäänud Na + katiooniga, et saada naatriumhüdroksiidi (Miks on tahke naatriumhüdriidi baasil ja mitte happel, kui reageeritakse veega?, 2016).
Reaktiivsus ja ohud
Ühend on võimas redutseeriv aine. Ründab SiO2 klaasi. See süttib kokkupuutel gaasilise F2, Cl2, Br2 ja I2 (viimane temperatuuridel üle 100 ° C), eriti niiskuse juuresolekul, moodustades HF, HCl, HBr ja HI..
Reageerib koos väävliga, saades Na2S ja H2S. See võib plahvatuslikult reageerida dimetüülsulfoksiidiga. Reageerib intensiivselt atsetüleeniga, isegi temperatuuril -60 ° C. See on fluoris süttiv.
See käivitab polümerisatsioonireaktsiooni etüül-2,2,3-trifluoropropionaadis, nii et ester laguneb tugevalt. Dietüülsuktsinaadi ja etüül-trifluoroatsetaadi reaktsioonis on esinenud plahvatusi (SODIUM HYDRIDE, 2016).
Naatriumhüdriidi peetakse naha või silmade söövitavaks, kuna vees leidub reaktsioonides naatriumhüdriid..
Silma sattumisel tuleb neid loputada suure koguse veega, silmalaugude all vähemalt 15 minutit ja pöörduda viivitamatult arsti poole..
Nahale sattumisel peske kohe ja loputage kahjustatud piirkond veega. Kui ärritus püsib, pöörduge arsti poole.
See on kahjulik vee allaneelamise tõttu. Ärge kutsuge esile oksendamist. Pöörduge viivitamatult arsti poole ja kandke kannatanu üle meditsiinikeskusesse.
Naatriumhüdriidi dispersioon õlis ei ole tolm. Kuid materjal, mis reageerib, võib välja tuua peene naatriumi. Sissehingamise korral loputada suud veega ja viia kannatanu värske õhu kätte. Pöörduda tuleb arsti poole (Rhom and Hass Inc., 2007).
Kasutamine
Naatriumhüdriidi peamine kasutusviis on kondensatsiooni- ja alküülimisreaktsioonide läbiviimine, mis tekivad karbaniooni moodustumise teel (mida katalüüsib alus)..
Naatrium õlis sarnaneb naatriumalkoholaadid ja metallilise naatriumi võimest toimida deprotoonimine agendi äädikhappeester, Claiseni kondensatsioone, Stobbe, Dieckmann ja seotud reaktsioone. See on selged eelised võrreldes teiste kondensaatorite, kus:
- See on tugevam alus, mille tulemuseks on otsesem deprotoonimine.
- Ülejääki ei ole vaja.
- Saadud H2 annab reaktsiooni ulatuse mõõtmise.
- Sekundaarsed reaktsioonid, nagu vähendamised, kõrvaldatakse.
Aromaatsete ja heterotsükliliste amiinide nagu 2-aminopüridiin ja fenotiasiin alküülimine on kergesti saavutatav suure saagisega, kasutades tolueeni-metüülformamiidi segusid. Dimetüülformamiidi kontsentratsioon on reaktsioonikiiruse kontrollimiseks kasutatav muutuja (HINCKLEY, 1957)..
On välja pakutud kasutamine Naatriumhüdriidi vesinikuhoidlatena kasutamiseks kütuseelemendiga sõidukite, hüdriidiauru vesinik kinnijäämine plastikust graanulid peenestatakse vee juuresolekul vabastama.
Viited
- HINCKLEY, M. D. (1957). Naatriumhüdriidi tootmine, käitlemine ja kasutamine. Advances in Chemistry, 19, 106-117.
- Mark Winter [Sheffieldi ülikool ja WebElements Ltd, U. (1993-2016)]. Naatrium: naatriumhüdriid. Välja otsitud veebikeskkonnast: webelements.com.
- Riiklik biotehnoloogia teabekeskus. (s.f.). PubChem Compound andmebaas; CID = 24758. Välja otsitud PubChem'ist: pubchem.ncbi.nlm.nih.gov.
- Rhom ja Hass inc. (2007, detsember). Naatriumhüdriid 60% dispersioon õlis. Välja otsitud aadressilt dow.com.
- Royal Society of Chemistry. (2015). Naatriumhüdriid. Välja otsitud ChemSpiderist: chemspider.com.
- SODIUM HYDRIDE. (2016). Välja võetud cameochemicals: cameochemicals.noaa.gov.
- Naatriumhüdriidi valem - naatriumhüdriidi kasutamine, omadused, struktuur ja valem. (2005-2017). Välja otsitud Softschools.com'ist: softschools.com.
- SODIUM HYDRIDE. (s.f.). Välja otsitud kemikaalikeskusest21: chemicalland21.com.
- Miks tahke naatriumhüdriid põhineb veega reageerimisel ja mitte happel? (2016, 20. aprill). Välja otsitud stackexchange'ist: chemistry.stackexchange.com.


