Molekulaarsed geomeetria tüübid ja näited
The molekulaarne geomeetria o molekulaarne struktuur on aatomite ruumiline jaotus keskse aatomi ümber. Aatomid esindavad piirkondi, kus on suur elektrooniline tihedus, ning seetõttu loetakse neid elektroonilisteks rühmadeks, olenemata sellest, millised lingid moodustavad (ühe-, kahe- või kolmekordsed).
See kontseptsioon on saadud kahe teooria: valentssideme (TEV) ja valentskesta (VSPR) elektrooniliste paaride tõukumise kombinatsioonist ja eksperimentaalsetest andmetest. Kui esimene määratleb lingid ja nende nurgad, siis teine määrab geomeetria ja seega molekulaarse struktuuri.

Millised geomeetrilised kujundid on molekulid, mis on võimelised vastu võtma? Kaks eelmist teooriat annavad vastused. Vastavalt VSEPR-le peavad vabade elektronide aatomid ja paarid olema paigutatud ruumi nii, et nende vahel tekib elektrostaatiline tõrjutus..
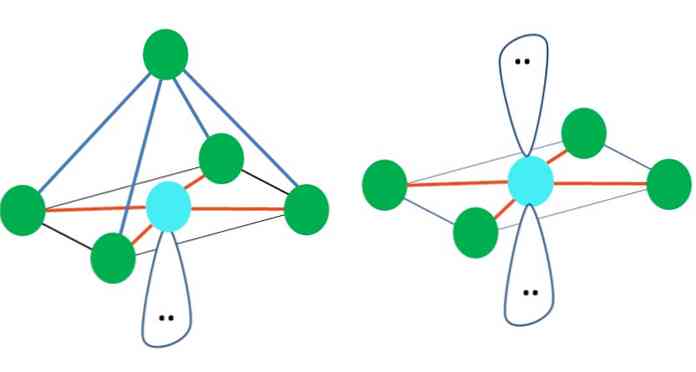
Niisiis, geomeetrilised kujundid ei ole meelevaldsed, vaid otsivad kõige stabiilsemat disaini. Näiteks ülemisel pildil võib vasakule näha kolmnurka ja paremale oktaeedri. Rohelised täpid esindavad aatomeid ja oranžid triibud lingid.
Kolmnurgas on kolm rohelist punkti orienteeritud 120 ° vahele. See nurk, mis on võrdne sidemega, võimaldab aatomitel üksteist võimalikult vähe tõrjuda. Seepärast võtab kolme teise elemendiga ühendatud aatomiga molekul vastu trigonaalse tasapinna geomeetria.
Kuid VSCR ennustab, et vaba elektronide paar keskmises aatomis moonutab geomeetria. Trigonaalse tasandi puhul surub see paar kolm rohelist punkti, mille tulemuseks on trigonaalse püramiidi geomeetria.
Sama võib juhtuda ka pildi oktaeedriga. Selles on kõik aatomid eraldatud kõige stabiilsemal viisil.
Indeks
- 1 Kuidas teada eelnevalt aatomi X molekulaarset geomeetriat?
- 2 tüüpi
- 2.1 Lineaarne
- 2.2 Nurk
- 2.3
- 2.4 Trigonaalne bipüramiid
- 2,5 oktaedraal
- 2.6 Muud molekulaarsed geomeetriad
- 3 Näited
- 3.1 Lineaarne geomeetria
- 3.2 Nurga geomeetria
- 3.3 Trigonaalne plaan
- 3.4
- 3.5 Trigonaalne püramiid
- 3.6 trigonaalne bipüramiid
- 3.7 Võnkumine
- 3.8 T kujutis
- 3.9 Oktaedraal
- 4 Viited
Kuidas eelnevalt teada aatomi X molekulaarne geomeetria?
Selleks on vaja kaaluda ka vabade elektronide paari elektrooniliste rühmadena. Need koos aatomitega määratlevad selle, mida nimetatakse elektrooniline geomeetria, mis on molekulaarse geomeetria lahutamatu kaaslane.
Elektroonilisest geomeetriast ja Lewise poolt tuvastatud vabade elektronide paaridest võime kindlaks teha, milline on molekulaarne geomeetria. Kõigi molekulaarsete geomeetriate summa annab ülevaate globaalsest struktuurist.
Tüübid
Nagu näha põhikuval, sõltub molekulaarne geomeetria sellest, kui palju aatomeid ümbritseb keskmist aatomit. Siiski, kui elektronide paar on ilma jagamiseta, muudab see geomeetriat, kuna see võtab palju köidet. Seetõttu avaldab see steerilist efekti.
Selle kohaselt võib geomeetria paljude molekulide jaoks esitada mitmeid iseloomulikke kujundeid. Ja seal tekivad erinevad molekulaarse geomeetria või molekulaarse struktuuri tüübid.
Millal on geomeetria struktuuriga võrdne? Mõlemad tähistavad seda ainult juhul, kui struktuuril ei ole rohkem kui ühte tüüpi geomeetria; vastasel juhul tuleb arvestada kõiki olemasolevaid tüüpe ja struktuuri anda üldnimetus (lineaarne, hargnenud, ümmargune, lame jne).
Geomeetriad on eriti kasulikud tahkete struktuuride selgitamiseks selle struktuuriüksustest.
Lineaarne
Kõik kovalentsed sidemed on suunalised, nii et ühendus A-B on lineaarne. Kuid kas AB-molekul on lineaarne?2? Kui jah, siis geomeetria on lihtsalt: B-A-B. Kaks B-aatomit on eraldatud 180 ° nurga all ja vastavalt TEV-le peab A-l olema spübriidsed orbitaalid.
Nurk
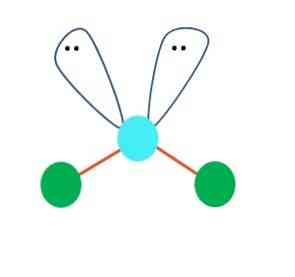
Esiteks võib eeldada AB molekuli lineaarset geomeetriat2; siiski on oluline teha Lewise struktuur enne järelduse tegemist. Joonistades Lewise struktuuri saab identifitseerida elektronide paaride arvu ilma jagamiseta (:) A-aatomil.
Kui see nii on, suruvad elektronpaaride peal kaks B aatomit alla, muutes nende nurgad. Selle tulemusena muutub lineaarne molekul B-A-B V-ks, bumerangiks või nurk-geomeetriaks (ülemine pilt)
Veemolekul H-O-H on sellist tüüpi geomeetria jaoks ideaalne näide. Hapniku aatomi juures on jagamata kaks elektronide paari, mis on orienteeritud ligikaudu 109º nurga all.
Miks see nurk? Kuna elektrooniline geomeetria on tetraedriline, millel on neli tippu: kaks H-aatomit ja kaks elektronid. Ülaltoodud pildil tuleb märkida, et rohelised täpid ja kaks "silmadega silmust" joonistavad sinise keskpunktiga tetreedri oma keskel.
Kui O-l poleks vaba elektronide paari, moodustaks vesi lineaarse molekuli, selle polaarsus väheneks ja ookeanid, mered, järved jne ei oleks ilmselt olemas, nagu nad on teada.
Tetrahedral
Ülemine pilt esindab tetraedrilist geomeetria. Veemolekuli jaoks on selle elektrooniline geomeetria tetraedriline, kuid elektronivabade paaride kõrvaldamisega võib täheldada, et see muundub nurk-geomeetriaks. Seda täheldatakse ka lihtsalt kahe rohelise punkti eemaldamisega; ülejäänud kaks tõmbavad V-d sinise täppiga.
Mis siis, kui kahe paari vaba elektroni asemel oli ainult üks? Siis oleks trigonaaltasand (peamine pilt). Elektroonilise rühma kõrvaldamisega ei väldita vabade elektronide paari tekitatud steerilist efekti. Seetõttu moonutab see trigonaaltasandit kolmnurkse püramiidiga:

Kuigi trigonaalne ja tetraedriline püramiidi molekulaarne geomeetria on erinevad, on elektrooniline geomeetria sama: tetraedriline. Seega ei loeta trigonaalset püramiidi elektrooniliseks geomeetriaks?
Vastus on "ei", kuna see on "silma silma" põhjustatud moonutuse ja steerilise efekti tulemus ning see geomeetria ei võta arvesse hilisemaid moonutusi.
Sel põhjusel on alati oluline kindlaks määrata elektrooniline geomeetria Lewise struktuuride abil enne molekulaarse geomeetria määratlemist. Ammoniaagi molekul, NH3, on näiteks trigonaalse püramiidi molekulaarse geomeetria näide, kuid tetraedriline elektrooniline geomeetria.
Trigonaalne bipüramiid
Siiani, välja arvatud lineaarne geomeetria, on nurgakujulise ja trigonaalse püramiidi tsentraalsed aatomid tsentraalse geomeetriaga hübridiseerunud3, vastavalt TEV-le. See tähendab, et kui teie linkide nurgad määrati eksperimentaalselt, peaksid need olema umbes 109º.
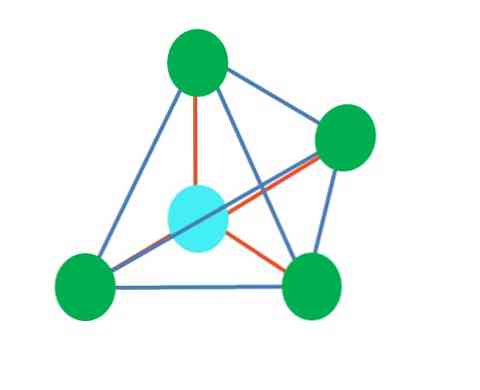
Trimonaalse dipiramiidse geomeetria põhjal on kesk-aatomi ümber viis elektroonilist rühma. Ülaltoodud pildil näete viit rohelist punkti; kolm kolmnurkses aluses ja kaks aksiaalses asendis, mis on püramiidi ülemine ja alumine tipp.
Milline hübridisatsioon on sinise täpiga? Lihtsaid sidemeid (oranž) moodustamiseks on vaja viit hübriidset orbitaali. See saavutatakse viie sp orbitaali kaudu3d (orbiidi s, kolme p ja a d segu segu).
Viie elektroonilise grupi kaalumisel on geomeetria selline, mis on juba eksponeeritud, kuid millel on jagamata paar elektronide paari, tekib jällegi moonutusi, mis tekitavad teisi geomeetriaid. Samuti tekib järgmine küsimus: kas need paarid võivad püramiidis asuda mis tahes asendis? Need on: aksiaalsed või ekvatoriaalsed.
Aksiaalsed ja ekvatoriaalsed positsioonid
Rohelised punktid, mis moodustavad kolmnurga aluse, paiknevad ekvaatoriasendis, samas kui kaks ülemist ja alumist otsa on aksiaalsetes asendites. Kui eelistatult paikneb elektronide paar ilma jagamiseta? Sellises asendis, mis minimeerib elektrostaatilist tõukumist ja steerilist toimet.
Aksiaalses asendis "elektron" paar "suruks" risti (90º) kolmnurksele alusele, kuigi kui see oleks ekvaatorilises asendis, oleks kaks ülejäänud baasil asuvat elektroonilist rühma 120º kaugusel ja vajutage mõlemat otsa 90º juures (mitte kolm, nagu aluse puhul.
Seetõttu püüab kesk-aatom oma elektronivaba paari orienteeruda ekvatoriaalsetes positsioonides, et luua stabiilsemaid molekulaarseid geomeetriaid.
Värviline ja T-kujuline
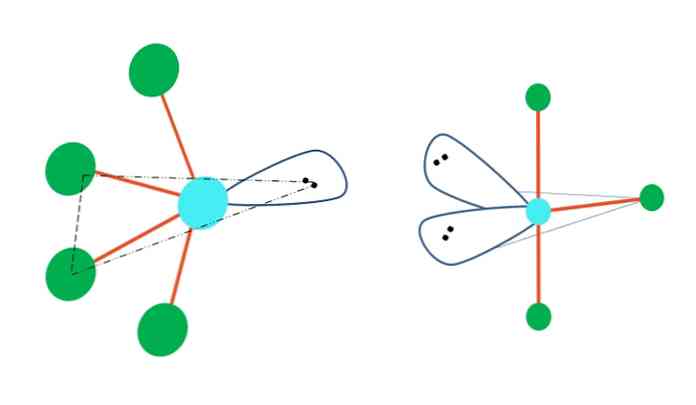
Kui trigonaalne bipüramiidgeomeetria peaks asendama ühe või mitu selle aatomit elektronivaba paariga, siis oleks sellel ka erinev molekulaarne geomeetria.
Ülemise pildi vasakul poolel muutub geomeetria võnkumist. Selles vabastavad vabad elektronid paar ülejäänud nelja aatomit samas suunas, painutades nende linke vasakule. Pange tähele, et see paar ja kaks aatomit asuvad sama dipüramiidi samas kolmnurktasandis.
Pildist paremal, T-kujuline geomeetria, mis on kahe elektroni paari kahe aatomi asendamise tulemus, mille tulemusena ülejäänud kolm aatomit on joondatud samas tasapinnas, mis tõmbab täpselt ühe tähe T.
Niisiis, AB-tüüpi molekuli jaoks5, see võtab vastu trigonaalse bipüramiidi geomeetria. Kuid AB4, samasuguse elektroonilise geomeetriaga võtab see vastu võnkumise geomeetria; ja AB3, T-kujulise geomeetriaga kõigil A-l on (üldiselt) spübridisatsioon3d.
Molekulaarse geomeetria määramiseks on vaja tõmmata Lewise struktuur ja seega selle elektrooniline geomeetria. Kui see on trigonaalne bipüramiid, siis jäetakse elektronivabad paarid kõrvale, kuid mitte nende staatiline toime ülejäänud aatomitele. Seega on võimalik kolme erineva molekulaarse geomeetria vahel suurepäraselt eristada.
Oktaedraalne
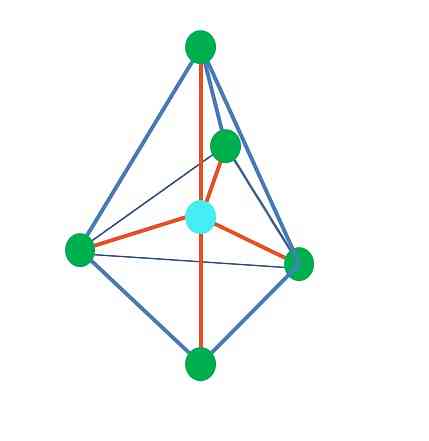
Oktaeedriline molekulaarne geomeetria on kujutatud põhipildi paremal pool. Seda tüüpi geomeetria vastab AB-ühenditele6. AB4 nad moodustavad ruudukujulise aluse, samas kui ülejäänud kaks B on paigutatud aksiaalsesse asendisse. Seega moodustuvad mitu võrdkülgset kolmnurka, mis on oktaeedri pinnad.
Siin võib jällegi olla (nagu kõikides elektroonilistes geomeetriades) vabad elektronipaarid ja seetõttu tulenevad sellest ka teised molekulaarsed geomeetriad. Näiteks AB5 oktaeedrilise elektroonilise geomeetriaga koosneb ruudukujulise alusega püramiid ja AB4 ruudukujulise tasapinnaga:
Oktaeedrilise elektroonilise geomeetria puhul on need kaks molekulaarset geomeetriat kõige stabiilsemad elektrostaatilise tõukumise seisukohast. Ruudukujulise tasapinnalise geomeetria puhul on kaks elektronide paari 180 °.
Milline on nende A geomeetria hübridisatsioon nendes geomeetria (või struktuurides, kui see on ainus)? Jällegi leiab TEV, et see on sp3d2, kuus hübriid-orbitaali, mis võimaldab A-l orienteerida oktaeedri tippude elektroonilisi rühmi.
Muud molekulaarsed geomeetriad
Siiani mainitud püramiidide aluste muutmisega on võimalik saada mõningaid keerukamaid molekulaarseid geomeetriaid. Näiteks viiesuunaline bipüramiid põhineb viiendal ja ühenditel, mis moodustavad selle üldvalemiga AB7.
Sarnaselt teiste molekulaarsete geomeetriatega moonutab B-aatomite asendamine elektronivaba paari jaoks geomeetria teistesse vormidesse.
Samuti on AB ühendid8 nad võivad vastu võtta geomeetriaid, nagu ruudu antiprism. Mõned geomeetriad võivad olla väga keerulised, eriti AB-valemite puhul7 alates (kuni AB12).
Näited
Järgmisena nimetatakse iga peamise molekulaarse geomeetria kohta ühendite rida. Harjutuseks võiksite joonistada Lewise struktuurid kõigi näidete jaoks ja kinnitada, kas elektroonilise geomeetria tõttu saad allpool loetletud molekulaarsed geomeetriad..
Lineaarne geomeetria
-Etüleen, H2C≡CH2
-Berülliumkloriid, BeCl2 (Cl-Be-Cl)
-Süsinikdioksiid, CO2 (O = C = O)
-Lämmastik, N2 (N≡N)
-Elavhõbe dibromiid, HgBr2 (Br-Hg-Br)
-Aniooni trijodiid, I3- (I-I-I)
-Vesiniktsüaniid, HCN (H-N≡C)
Selle nurgad peavad olema 180º ja seetõttu peavad nad olema hübridiseerunud.
Nurga geomeetria
-Vesi
-Vääveldioksiid, SO2
-Lämmastikdioksiid, NO2
-Osoon, O3
-Anion amiduro, NH2-
Trigonaalne tasand
-Broomtrifluoriid, BF3
-Alumiiniumtrikloriid, AlCl3
-Nitraatanioon, NO3-
-Anioonkarbonaat, CO32-
Tetrahedral
-Metaangaas, CH4
-Süsiniktetrakloriid, CCl4
-Katiooni ammoonium, NH4+
-Anioonsulfaat, SO42-
Trigonaalne püramiid
-Ammoniaak, NH3
-Katioonhüdronium, H3O+
Trigonaalne bipüramiid
-Fosforpentafluoriid, PF5
-Antimon Pentakloriid, SbF5
Võnkumine
Vääveltetrafluoriid, SF4
T kuju
-Jooditrikloriid, ICl3
-Kloriidi trifluoriid, ClF3 (mõlemad ühendid on tuntud kui interhalogeenid)
Oktaedraalne
-Väävelheksafluoriid, SF6
-Seleenheksafluoriid, SeF6
-Heksafluorofosfaat, PF6-
Molekulaarse geomeetria kulminatsiooniks on aine keemiliste või füüsikaliste omaduste vaatlused. Siiski on see orienteeritud elektroonilisele geomeetriale, nii et viimane tuleb alati kindlaks määrata enne esimest.
Viited
- Whitten, Davis, Peck & Stanley. Keemia (8. väljaanne). CENGAGE-õpe, lk 194-198.
- Shiver & Atkins. (2008). Anorgaaniline keemia (Neljas väljaanne., Lk 23, 24, 80, 169). Mc Grawi mägi.
- Mark E. Tuckerman. (2011). Molekulaarne geomeetria ja VSEPR teooria. Välja otsitud andmebaasist: nyu.edu
- Virtual Chembook, Charles E. Ophardt. (2003). Molekulaarse geomeetria tutvustus. Välja otsitud andmebaasist: chemistry.elmhurst.edu
- Keemia LibreTexts. (8. september 2016). Molekulide geomeetria. Välja otsitud andmebaasist: chem.libretexts.org


