Etaani struktuur, omadused, kasutusalad ja riskid
The etaan on lihtne süsivesinik valemiga C2H6 värvitu ja lõhnatu gaasiga, millel on etüleeni sünteesil väga väärtuslik ja mitmekesine kasutamine. Lisaks on see üks maismaagaasidest, mida on avastatud ka teistes planeedides ja tähtkehades päikesesüsteemi ümbruses. Selle avastas 1834. Aastal teadlane Michael Faraday.
Süsiniku ja vesiniku aatomite (süsivesinikud) moodustatud suure hulga orgaaniliste ühendite hulgas on neid, mis on temperatuuri ja keskkonnarõhu tingimustes gaasilises olekus, mida kasutatakse paljudes tööstusharudes tohutult..
Tavaliselt pärinevad need gaasilisest segust, mida nimetatakse "maagaasiks", mis on inimkonnale väga väärtuslik toode ja mis koosneb muu hulgas metaani, metaani, etaani, propaani ja butaani metaanist; klassifitseeritakse vastavalt selle ahela süsinikuaatomite kogusele.
Indeks
- 1 Keemiline struktuur
- 1.1 Etaani süntees
- 2 Atribuudid
- 2.1 Etaani lahustuvus
- 2.2 Etaani kristallisatsioon
- 2.3 Etaani põletamine
- 2.4 Etaan atmosfääris ja taevakehades
- 3 Kasutamine
- 3.1. Etüleeni tootmine
- 3.2 Põhikemikaalide koolitus
- 3.3 Külmutusaine
- 4 Etaani riskid
- 5 Viited
Keemiline struktuur
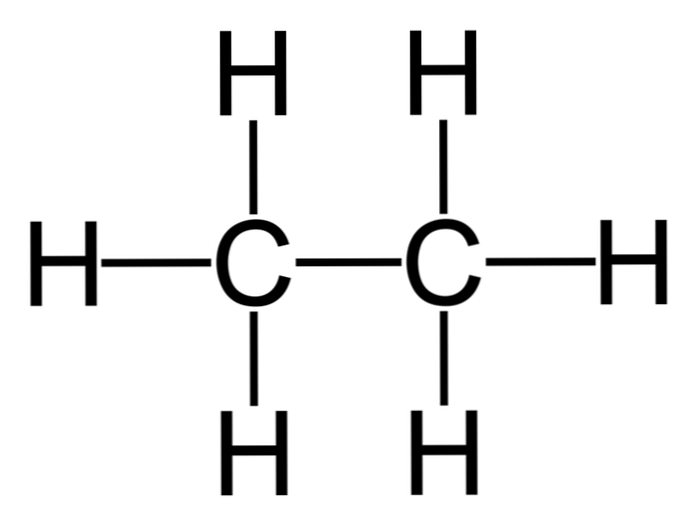
Etaan on valemiga C molekul2H6, seda peetakse tavaliselt kahe metüülrühma (-CH) liiteks3) moodustab lihtsa süsinik-süsiniksideme süsivesiniku. See on ka lihtsaim orgaaniline ühend pärast metaani, mis on järgmine:
H3C-CH3
Selle molekuli süsinikuaatomid omavad spibridisatsiooni3, seega on molekulaarsed sidemed vaba.
Samuti on olemas sisemine nähtus, mis põhineb etaanil, mis põhineb sama molekuli struktuuri pöörlemisel ja minimaalse energiaga, mis on vajalik 360 kraadi sideme pööramiseks, mida teadlased on nimetanud "etaani barjääriks"..
Sel põhjusel võib etaan esineda erinevates konfiguratsioonides vastavalt selle pöörlemisele, kuigi selle stabiilsem konformatsioon on olemas, kui vesinikud on üksteise vastas (nagu on näidatud joonisel)..

Etaani süntees
Etaani saab kergesti sünteesida Kolbe elektrolüüsist, orgaanilisest reaktsioonist, milles toimub kaks etappi: kahe karboksüülhappe elektrokeemiline dekarboksüülimine (karboksüülrühma eemaldamine ja süsinikdioksiidi eraldumine) ning toodete kombinatsioon. vaheühendid kovalentse sideme moodustamiseks.
Sarnaselt põhjustab äädikhappe elektrolüüs etaani ja süsinikdioksiidi moodustumist ning seda reaktsiooni kasutatakse esimese ühendi sünteesimiseks..
Äädikhappe anhüdriidi oksüdeerimine peroksiidide toimel, mis on sarnane Kolbe elektrolüüsiga, põhjustab samuti etaani moodustumist..
Samamoodi saab seda maagaasist ja metaanist tõhusalt eraldada veeldamise teel, kasutades selle gaasi kogumiseks krüogeenseid süsteeme ja eraldada see teiste gaasidega segudest..
Selle rolli puhul on eelistatud turbopaisumise protsess: gaasisegu viiakse läbi turbiini, tekitades selle laienemise, kuni selle temperatuur langeb alla -100ºC.
Juba praegu võib segu komponente diferentseerida, nii et vedel etaan eraldatakse gaasilisest metaanist ja muudest destilleerimisega seotud liikidest..
Omadused
Etaan esineb looduses lõhnatu ja värvitu gaasina standardrõhul ja temperatuuridel (1 atm ja 25 ° C). Selle keemistemperatuur on -88,5 ° C ja sulamistemperatuur on -182,8 ° C. Lisaks sellele ei mõjuta seda tugevate hapete või aluste kokkupuude.
Etanooli lahustuvus
Etaani molekulid on sümmeetrilised ja neil on nõrgad tõmbejõud, mis hoiavad neid koos, mida nimetatakse dispersioonijõududeks.
Kui etaani proovitakse vees lahustuda, on gaasi ja vedeliku vahel moodustunud tõmbejõud väga nõrgad, nii et etaani on väga raske ühendada veemolekulidega.
Sel põhjusel on etaani lahustuvus tunduvalt madal, kasvades pisut, kui süsteemi rõhk tõuseb.
Etaani kristallisatsioon
Etaani võib tahkuda, mille tulemusena moodustub kuubilise kristallstruktuuriga ebastabiilsed etaani kristallid.
Kui temperatuur langeb üle -183,2 ° C, muutub see struktuur monokliiniliseks, suurendades selle molekuli stabiilsust.
Etaani põlemine
Seda süsivesinikku, kuigi seda ei kasutata laialdaselt kütusena, võib kasutada põlemisprotsessides süsinikdioksiidi, vee ja soojuse tekitamiseks, mida kirjeldatakse järgmiselt:
2C2H6 + 7O2 → 4CO2 + 6H2O + 3120 kJ
Samuti on võimalus seda molekuli põletada ilma hapniku liigita, mis on tuntud kui "mittetäielik põlemine" ja mille tulemuseks on amorfse süsiniku ja süsinikmonooksiidi moodustumine soovimatu reaktsioonis, sõltuvalt kasutatava hapniku kogusest. :
2C2H6 + 3O2 → 4C + 6H2O + soojus
2C2H6 + 4O2 → 2C + 2CO + 6H2O + soojus
2C2H6 + 5O2 → 4CO + 6H2O + soojus
Selles valdkonnas toimub põletamine rea vabade radikaalide reaktsioonide kaudu, mis on nummerdatud sadade erinevate reaktsioonide järgi. Näiteks ühendid, nagu formaldehüüd, atsetaldehüüd, metaan, metanool ja etanool, võivad olla moodustatud mittetäielikul põlemisreaktsioonil..
See sõltub reaktsioonitingimustest ja kaasatud vabade radikaalide reaktsioonidest. Etüleeni võib moodustada ka kõrgetel temperatuuridel (600-900 ° C), mis on tööstuse poolt väga soovitud toode.
Etaan atmosfääris ja taevakehad
Etaan on maapinna atmosfääris jälgedes ja kahtlustatakse, et inimene on suutnud seda koondumist kahekordistada, kuna ta hakkas harrastama tööstustegevust.
Teadlased arvavad, et suur osa atmosfääris olevast etaani olemasolust on tingitud fossiilkütuste põlemisest, kuigi ülemaailmne etaani heitkogus on vähenenud peaaegu poole võrra, kuna kildagaasi tootmise tehnoloogiad on paranenud (a maagaasi allikas).
Seda liiki toodetakse loomulikult ka päikesekiirguse mõjuga atmosfääri metaanile, mis koondab ja moodustab etaani molekuli..
Etaan eksisteerib vedelas olekus Titani peal, üks Saturni kuuest. See toimub suuremas koguses Vid Flumina jões, mis voolab rohkem kui 400 kilomeetri suunas ühe oma mereni. Seda ühendit on tõestatud ka komeedidel ja Pluto pinnal.
Kasutamine
Etüleeni tootmine
Etaani kasutamine põhineb peamiselt etüleeni tootmisel, mis on maailma kõige enam kasutatav mahepõllumajanduslik toode, mida tuntakse aurufaasis..
See protsess seisneb auruga lahjendatud etaani etteandmises ahjus, kuumutades seda kiiresti ilma hapnikuta.
Reaktsioon toimub väga kõrgel temperatuuril (vahemikus 850 kuni 900 ° C), kuid viibimise aeg (aeg, mis kulub ahjus oleval etaanil) peab olema lühike, et reaktsioon oleks tõhus. Kõrgematel temperatuuridel tekib rohkem etüleeni.
Põhikemikaalide koolitus
Etaani on uuritud ka põhikemikaalide moodustamise põhikomponendina. Oksüdatiivne kloorimine on üks protsess, mida pakutakse vinüülkloriidi (PVC komponendi) saamiseks, asendades odavamad ja keerukamad..
Jahutusvedelik
Lõpuks kasutatakse etaani külmutusainena tavapärastes krüogeensetes süsteemides, näidates samuti võimalust laboris analüüsida väikeseid proove..
See on vee hea asendaja, mis võtab tundlike proovide jahutamiseks kauem aega ja võib tekitada ka kahjulikke jääkristalle.
Etaani riskid
-Etaan on võimeline süttima, eriti kui see seondub õhuga. Etaani sisaldus õhus 3,0 kuni 12,5%, võib moodustada plahvatusohtlik segu.
-See võib piirata hapnikku õhus, milles see leidub, ning seetõttu kujutab see ohtu, et inimesed ja loomad võivad sattuda lämbumisse..
-Külmutatud vedelas vormis etaan võib nahka tõsiselt põletada, kui see on otseses kokkupuutes sellega, ning toimib ka krüogeense keskkonnana mis tahes eseme puhul, mida see puudutab, külmutades selle hetkedel.
-Vedela etaani aurud on õhust raskemad ja kontsentreeruvad maapinnale, mis võib põhjustada süttimisohtu, mis võib tekitada ahela põlemisreaktsiooni.
-Etaani allaneelamine võib põhjustada iiveldust, oksendamist ja sisemist verejooksu. Sissehingamine põhjustab lisaks lämbumisele peavalu, segasust ja meeleolumuutusi. Surm südame seiskumise tõttu on võimalik kõrge kokkupuute korral.
-See kujutab endast kasvuhoonegaasi, mis koos metaaniga ja süsinikdioksiidiga aitab kaasa globaalsele soojenemisele ja kliimamuutustele, mis tulenevad inimeste saastamisest. Õnneks on see vähem rikkalik ja vastupidav kui metaan ning see neelab vähem kiirgust.
Viited
- Britannica, E. (s.f.). Ethane. Välja otsitud britannica.com-st
- Nes, G. V. (s.f.). Etaani, etüleeni ja atsetüleeni ühekristallstruktuurid ja elektrontiheduse jaotused. Taastatud reg.nl
- Sites, G. (s.f.). Etaan: allikad ja valamud. Välja otsitud saidilt.google.com
- SoftSchools. (s.f.). Etaani valem. Taastatud softschools.com
- Wikipedia. (s.f.). Ethane. Välja otsitud aadressilt en.wikipedia.org


