Naatriumdikromaadi omadused, tootmine, ohud ja kasutusalad
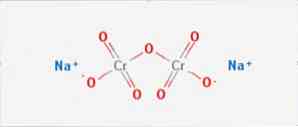
The naatriumdikromaat on anorgaaniline ühend valemiga Na2Cr2O7. See on üks paljudest kuuevalentsetest kroomiühenditest (Cr VI). Selle struktuuri on illustreeritud joonisel 1, kuigi tavaliselt töödeldakse soola dihüdreeritud kujul, mille valemiks on Na2Cr2O7 · H2O..
Naatriummolekulide ja negatiivselt laetud oksiidide vahel on kaks ioonsidet. Kroomimaak ekstraheeritakse naatriumdikromaadist. Igal aastal toodetakse miljoneid kilogrammi naatriumdikromaati.
Hiina on suurim naatriumdikromaadi tootja, kuid Hiina keemiatehaste toodang on suhteliselt madal, vähem kui 50 000 tonni aastas, võrreldes Kasahstani tehase tootmisega üle 100 000 tonni aastas.
Venemaal, Ameerika Ühendriikides ja Ühendkuningriigis asuvate taimede toodang on vahemikus 50 000–100 000 tonni aastas (Kogel, 2006)..
Reaktiivsuse ja välimuse poolest on naatriumdikromaadil kaaliumdikromaadiga sarnased omadused, kuid naatriumisool on vees rohkem lahustuv ja selle kaalu ekvivalent on väiksem kui kaaliumsool.
Naatriumdikromaat tekitab kuumutamisel toksilisi kroomiaurusid. See on tugev oksüdeeriv aine ja on väga söövitav.
Seda ühendit võib leida joogiveeallikatest, mis on saastunud erinevate tööstuslike protsessidega, nagu galvaniseerimis- või galvaniseerimismeetodid, naha parkimine ja tekstiiltoodete tootmine..
Indeks
- 1 Füüsikalised ja keemilised omadused
- 2 Tootmismeetodid
- 3 Reaktiivsus ja ohud
- 4 Kasutamine ja rakendused
- 5 Biokeemia
- 6 Viited
Füüsikalised ja keemilised omadused
Naatriumdikromaat koosneb kristallidest, mille veevaba ja lõhnatu vorm on punakasoranži monokliiniline struktuur. Selle molekulmass on 261,97 g / mol veevabas vormis ja 298,00 g / mol dihüdraadis..
Selle sulamispunkt on 356,7 kraadi Celsiuse järgi, mille keemistemperatuur on 400 ° C ja milles see laguneb. Selle tihedus on 2,52 g / ml.

Joonis 2 näitab naatriumdikromaadi välimust. Selle lahustuvus vees on 187 g 100 grammi kohta 25 kraadi juures ja selle lahustuvus etanoolis on 513,2 grammi liitri kohta 19,4 kraadi juures (riiklik biotehnoloogia teabe keskus, sf.).
Seda hoitakse stabiilse ühendina, kui seda hoitakse soovitatud tingimustel ja ei ole tuleohtlik. Kuna tegemist on tugeva oksüdeeriva ainega, on see söövitav ja lahuses on happelahus, mis võimaldab 1% w / v lahuses pH alandada tasemele 4.
Tootmismeetodid
Naatriumkromaati võib muuta dikromaadiks pideva protsessiga, mis käsitleb väävelhapet, süsinikdioksiidi või nende kahe kombinatsiooni..
Naatriumdikromaadi lahuse aurustamine põhjustab naatriumsulfaadi ja / või naatriumvesinikkarbonaadi sadestumise ning need ühendid eemaldatakse enne naatriumdikromaadi lõplikku kristalliseerumist..
Naatriumdikromaati saab teha kolmeastmelises protsessis:
- Kroomi oksüdatsioonitingimuste leeliseline röstimine
- Leaching. Lahustuva aine ekstraheerimine segust vedela lahusti toimel
- Naatriummonokromaadi muundamine naatriumdikromaadina happe abil.
Veevaba naatriumdikromaati võib valmistada naatriumdihüdraadi dihüdraadi sulatamisega, kristalliseerides dikromaadi vesilahuseid üle 86 ° C või kuivatades naatriumdikromaadi lahuseid pihustuskuivatites..
Naatriumdikromaadi lahuseid temperatuuril 69 ja 70 massiprotsenti kasutatakse sobiva ja kulutõhusa koguste saatmise meetodina, vältides kristallide käsitsi teisaldamist või lahustumist.
Reaktiivsus ja ohud
See on tugev oksüdeeriv aine. Kokkusobimatu tugevate hapetega. Kokkupuude põlevate materjalidega võib põhjustada tulekahju. Kroomoksiidi toksilisi aure võib moodustada kuumuse või tule juuresolekul.
Dikromaadi ja väävelhappe teadaolev "kroomhappe segu" koos orgaaniliste jääkidega põhjustab vägivaldse eksotermilise reaktsiooni. See segu koos atsetooni jääkidega põhjustab ka vägivaldse reaktsiooni.
Dikromaadi ja väävelhappe kombinatsioon alkoholide, etanooli ja 2-propanooliga põhjustab vägivaldse eksotermilise reaktsiooni. Paljude dikromaat-väävelhappe oksüdeeritavate orgaaniliste materjalidega segamise juhtumite tõttu on tõenäoline, et selliseid koostoimeid on kõige parem vältida.
Dikromaadi ja hüdrasiini kombinatsioon on plahvatusohtlik, eeldatakse, et dikromaadi reaktsioon on amiinidega üldiselt jõuline. Dehüdraaditud dikromaatsoola lisamine äädikhappe anhüdriidile põhjustab lõpuks plahvatusohtliku eksotermilise reaktsiooni.
Boor, räni ja dikromaadid moodustavad pürotehnilisi segusid. Äädikhappe, 2-metüül-2-pentenali ja dikromaadi segu põhjustab ohjeldamatu reaktsiooni (Chemical Datasheet Sodium Dichromate., 2016).
Tolmu või udu sissehingamine põhjustab hingamisteede ärritust, mis mõnikord meenutab astmat. Võib esineda septeptiline perforatsioon. Seda peetakse mürgiks.
Allaneelamine põhjustab oksendamist, kõhulahtisust ja väga ebatavaliselt mao ja neeru komplikatsioone. Kokkupuude silmade või nahaga põhjustab lokaalset ärritust. Korduv kokkupuude nahaga põhjustab dermatiiti.
Naatriumdikromaat on inimestel kantserogeen. On tõendeid, et kuusevalentsed kroomiühendid või Cr (VI) võivad inimestel põhjustada kopsuvähki. On näidatud, et naatriumdikromaat põhjustab loomadel kopsuvähki.
Kuigi naatriumdikromaati ei ole teratogeenseks ühendiks või reproduktiivseks ohuks, on teada, et kuusevalentsed kroomiühendid või Cr (VI) on teratogeensed ja põhjustavad reproduktiivset kahjustust, nagu viljakuse vähendamine ja menstruaaltsüklite häirimine.
Naatriumdikromaat võib põhjustada maksa- ja neerukahjustusi, mistõttu tuleb seda hoolikalt juhtida (New Jersey tervishoiuministeerium, 2009).
Allaneelamise korral peab kannatanu juua vett või piima; kunagi oksendamist. Nahale või silma sattumisel tuleb seda ravida happe põletustena; Loputage silmi veega vähemalt 15 minutit.
Väliseid kahjustusi saab hõõruda 2% naatriumtiosulfaadi lahusega. Kõigil juhtudel tuleb konsulteerida arstiga.
Kasutused ja rakendused
Lisaks selle tähtsusele teiste kroomi kemikaalide valmistamisel on naatriumdikromaadil ka palju otseseid kasutusviise koostisosana: \ t
- Metallist viimistlus: aitab korrosioonikindlusel ja puhastada metallpindu, soodustab ka värvi kleepumist.
- Orgaanilised tooted: kasutatakse oksüdeerijatena selliste toodete valmistamisel nagu K-vitamiin ja vaha.
- Pigmendid: kasutatakse anorgaaniliste kromaatsete pigmentide valmistamiseks, kui see toodab valgustugevust. Mõningaid kromaadi klasse kasutatakse ka alumise kihi ja praimerite korrosiooni inhibiitoritena.
- Keraamilised: kasutatakse värviliste klaaside ja keraamiliste klaaside valmistamiseks.
- Tekstiil: kasutatakse happeliste värvide mordinaatorina, et parandada selle kiiret värvimist.
- Kroomsulfaadi tootmine.
(Naatriumdikromaat, praktiliselt kõigi teiste kroomiühendite ehitusplokk., 2010-2012)
Naatriumdikromaat Dihüdraat, selle kasutamine on ideaalne mitmesugustes tingimustes, kaasa arvatud kõrgtemperatuurilised rakendused, nagu keraamilised glaadid ja värviline klaas.
Kroomoksiid, mis on raskem kui muud metalloksiidid, nagu titaan või raud, on ideaalne keskkondades, kus temperatuur ja protsessi tingimused on agressiivsed.
Seda ainet kasutatakse peamiselt muude kroomiühendite tootmiseks, kuid seda kasutatakse ka bentoniitmududes, mida kasutatakse õli tootmisel, puidu säilitusainetes, orgaaniliste kemikaalide tootmisel ja korrosiooni inhibiitorina..
Alumiinium- ja kaaliumdikromaadiga segamisel, kasutades alumiinium-termilist protsessi, tekitab kroomoksiid kõrge puhtusastmega metallkroomi. See on kosmosetööstuses kasutatavate suure jõudlusega supersulamite tootmise oluline koostisosa.
Orgaanilises sünteesis kasutatakse oksüdeeriva ainena naatriumdikromaati redutseerivate oksiidide reaktsioonides väävelhappe juuresolekul.
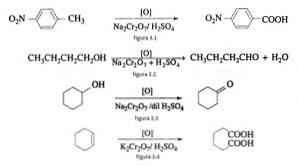
Näiteks p-nitrotolueeni oksüdeerimine p-nitrobensoehappe moodustamiseks n-butanooli oksüdeerimisel, et moodustada n-butaldehüüd, tsükloheksanoolist moodustumisel ja adipiinhappe moodustumisel, nagu on näidatud joonistel 3.1. , 3,2, 3,3 ja 3,4 (VK Ahluwalia, 2004).
Biokeemia
Naatriumdikromaadi (CrVI) ja kroomatsetaadi hüdroksiidi (CrIII) intratrakeaalne instillatsioon isastel rottidel tõi kaasa kroomi kontsentratsiooni suurenemise täisveres, plasmas ja uriinis kuni 72 tundi pärast kokkupuudet; Maksimaalne kontsentratsioon saavutati 6 tundi pärast kokkupuudet.
Kroomi ja kroomi kontsentratsioonide koguarv vereproovide vahel oli Cr (VI) ja Cr (III) ravi puhul oluliselt erinev. Seetõttu tuleks kroomi ekspositsiooni hindamiseks kasutada veres ja kroomis sisalduva kroomi analüüse.
Kroom tuvastati ka perifeersetes lümfotsüütides. Pärast töötlemist lümfotsüütides ei kogunenud olulisel määral Cr (VI), kuid mitte Cr (III). Neil rakkudel on potentsiaali kasutada biomarkeritena kroomiühendite kokkupuute hindamisel (Hooth, 2008)..
Viited
- Keemiline andmeleht naatriumdikromaat. (2016). Välja otsitud kemikaalidest: cameochemicals.noaa.
- Hooth, M. J. (2008). Dihüdraadi naatriumdikromaadi toksikoloogia ja kartsinogeneesi tehniline aruanne. Riiklik Terviseinstituut USA.
- Kogel, J. E. (2006). Tööstuslikud mineraalid ja kivid: kaubad, turud ja seitsmes väljaanne. littleton colorado: kaevandus-, metallurgia- ja uurimiskeskus.
- Riiklik biotehnoloogia teabekeskus. (s.f.). PubChem Compound andmebaas; CID = 25408. Välja otsitud aadressilt pubchem.com: pubchem.ncbi.nlm.nih.gov.
- New Jersey tervishoiuministeerium. (2009, november). naatriumdikromaat. Välja otsitud andmebaasist nj.gov: nj.gov.
- Naatriumdikromaat. Peamiselt kõigi teiste kroomiühendite ehitusplokk. (2010-2012). Välja otsitud elementist chromium: elementischromium.com
- K. Ahluwalia, R. A. (2004). Põhjalik praktiline orgaaniline keemia: valmistised ja kvantitatiivsed analüüsid. Delhi: ülikooli ajakirjandus (India).


