Ketoonide tüübid, omadused, nomenklatuur, kasutusalad ja näited
The ketoonid need on orgaanilised ühendid, millel on karbonüülrühm (-CO). Need on lihtsad ühendid, milles karbonüülrühma süsinik on seotud kahe süsinikuaatomiga (ja nende asendusahelatega). Ketoonid on "lihtsad", sest neil ei ole süsinikuga seotud reaktiivseid rühmi, nagu -OH või -Cl.
Lõpuks seostatakse ketoonide eemaldamine inimkehast tavaliselt suhkru madala tasemega (diabeetikutel ja / või äärmiselt tühja kõhuga), mis võib patsiendile põhjustada tõsiseid terviseprobleeme..
Indeks
- 1 Ketoonide üldvalem
- 2 Ketoonide tüübid
- 2.1 Keti struktuuri järgi
- 2.2 Vastavalt selle radikaalide sümmeetriale
- 2.3 Vastavalt selle radikaalide küllastumisele
- 2.4 Detsetoonid
- 3 Ketoonide füüsikalised ja keemilised omadused
- 3.1 Keemistemperatuur
- 3.2 Lahustuvus
- 3.3 Happesus
- 3.4 Reaktsioonivõime
- 4 Nomenklatuur
- 5 Aldehüüdide ja ketoonide erinevus
- 6 Kasutatakse tööstus- ja igapäevaelu
- 7 Ketoonide näited
- 7.1 Butanoon (C4H8O)
- 7.2. Tsükloheksanoon (C6H10O)
- 7.3 Testosteroon (C19H22O2)
- 7.4 Progesteroon (C21H30O2)
- 8 Viited
Ketoonide üldvalem
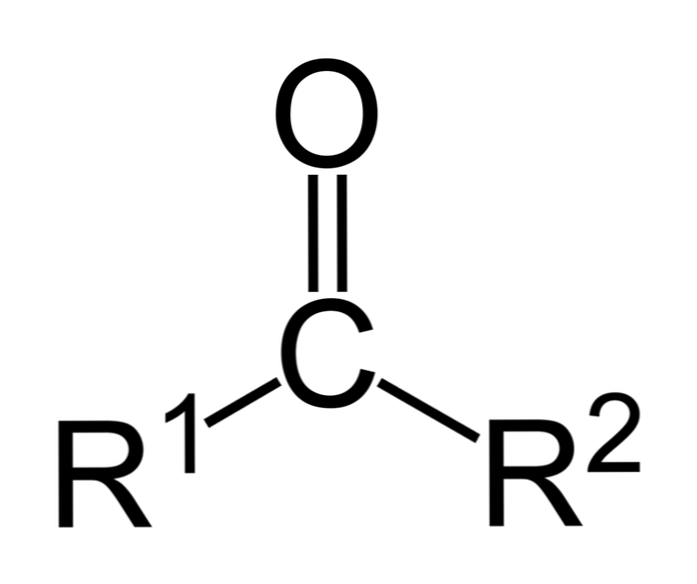
Ketoonid on karbonüülühendid, milles see rühm on seotud kahe süsivesiniku rühmaga; need võivad olla alküülrühmad, benseenitsüklirühmad või mõlemad.
Ketooni võib lihtsalt kujutada kui R- (C = O) -R ', kus R ja R' on kaks süsivesiniku ahelat (alkaanid, alkeenid, alkünid, tsükloalkaanid, benseeni derivaadid ja teised). Karbonüülrühma külge kinnitatud vesinikuga ketoneid ei ole.
Ketoonide valmistamiseks tööstus- ja laborikeskkonnas on palju erinevaid meetodeid; Lisaks on oluline märkida, et ketoneid saab sünteesida erinevate organismide, sealhulgas inimeste poolt.
Tööstuses hõlmab ketoonide kõige tavalisem meetod süsivesinike oksüdeerimist, tavaliselt õhu kasutamisel. Väikeses ulatuses valmistatakse ketoonid tavaliselt sekundaarsete alkoholide oksüdeerimise teel, mis annab produktidena ketooni ja vett..
Lisaks nendele kõige tavalisematele meetoditele võib ketoneid sünteesida alkeenide, alküünide, lämmastikuühendite soolade, estrite ja paljude teiste ühendite kaudu, mis muudab need kergesti kättesaadavaks..
Ketoonide tüübid
Ketoonide klassifikatsioonid on mitmed, sõltuvalt peamiselt nende ahelas asuvatest asendajatest. Järgmised on nende ainete kõige levinumad klassifikatsioonid:
Vastavalt teie keti struktuurile
Sel juhul klassifitseeritakse ketoon selle ahela struktuuri järgi: alifaatsed ketoonid on need, millel on kaks radikaali R ja R ', mis on alküülradikaalide (alkaanid, alkeenid, alkünid ja tsükloalkaanid) kujul..
Aromaatsed ained on omakorda need, mis moodustavad benseeni derivaate, olles siiski ketoonideks. Lõpuks on segatud ketoonid need, millel on R-alküülradikaal ja R 'arüülradikaal või vastupidi.
Vastavalt selle radikaalide sümmeetriale
Sel juhul uuritakse karbonüülrühma radikaale R ja R '; kui need on võrdsed (identsed), nimetatakse ketooni sümmeetriliseks; kuid kui nad on erinevad (nagu enamik ketoneid), nimetatakse seda asümmeetriliseks.
Vastavalt selle radikaalide küllastumisele
Ketoone võib klassifitseerida ka nende süsinikahelate küllastumise järgi; Kui need on alkaanide kujul, nimetatakse ketooni küllastunud ketooniks. Vastupidiselt sellele, kui ahelad on leitud alkeenidena või alküünidena, nimetatakse ketooni küllastumata ketooniks.
Detsetoonid
See on ketooni eraldi klass, kuna selle ketooni ahelatel on nende struktuuris kaks karbonüülrühma. Mõnedel neist ketoonidest on unikaalsed omadused, näiteks pikem side süsiniku vahel.
Näiteks tsükloheksaanist saadud diketoonid on tuntud kui kinoonid, mis on ainult kaks: orto-bensokinoon ja para-bensokinoon.
Ketoonide füüsikalised ja keemilised omadused
Ketoonid, nagu enamik aldehüüde, on vedelad molekulid ja neil on mitmeid füüsikalisi ja keemilisi omadusi, mis varieeruvad sõltuvalt nende ahelate pikkusest. Selle omadusi kirjeldatakse allpool:
Keemistemperatuur
Ketoonid on väga lenduvad, väga polaarsed ja ei saa vesinikud siduda vesiniksidemetega (neil ei ole karbonüülrühma külge kinnitatud vesinikuaatomeid), mistõttu neil on kõrgemad keemispunktid kui alkeenid ja eetrid, kuid need on madalamad kui sama molekulmassiga alkoholid.
Ketooni keemistemperatuur suureneb, kui molekuli suurus suureneb. Selle põhjuseks on van der Waalsi jõudude ja dipool-dipooljõudude sekkumine, mis nõuavad suuremat energiat, et eraldada molekulile ligitõmbavad aatomid ja elektronid..
Lahustuvus
Ketoonide lahustuvus mõjutab osaliselt nende molekulide võimet aktsepteerida vesinikke hapniku aatomis ja moodustada seega vesiniksideme veega. Lisaks tekivad ketoonide ja vee vahel atraktiivsed, hajutatavad ja dipool-dipoolsed jõud, mis suurendavad nende lahustuvat toimet.
Ketoonid kaotavad lahustuvuse, mida suurem on nende molekul, kuna nad hakkavad vees lahustumiseks rohkem energiat nõudma. Nad lahustuvad ka orgaanilistes ühendites.
Happelisus
Tänu karbonüülrühmale on ketoonid happelised; see juhtub selle funktsionaalse rühma resonantsstabiliseerimisvõime tõttu, mis suudab oma kaksiksidemetest prootoneid kanda konjugeeritud aluse, mida nimetatakse enooliks, moodustamiseks..
Reaktsioonivõime
Ketoonid on osa paljudest orgaanilistest reaktsioonidest; see on tingitud selle karbonüül süsiniku tundlikkusest nukleofiilsele lisandile lisaks selle polaarsusele..
Nagu eespool öeldud, muudab ketoonide kõrge reaktsioonivõime nende tunnustatud vaheproduktiks, mis on aluseks teiste ühendite sünteesimiseks.
Nomenklatuur
Ketoonid nimetatakse karbonüülrühma prioriteedi või tähtsuse järgi kogu molekulis, nii et kui teil on karbonüülrühma reguleeritav molekul, nimetatakse ketoon, lisades sufiksi "-one" süsivesiniku nimele..
Peamine karbonüülrühmaga ahel võetakse peamiseks ahelaks ja seejärel nimetatakse molekuli. Kui karbonüülrühm ei ole molekuli teiste funktsionaalsete rühmade ees prioriteetne, siis identifitseeritakse see "-oxo" -ga..
Keerulisemate ketoonide jaoks võib funktsionaalse rühma positsiooni identifitseerida numbriga ja diketoonide (ketoonid, millel on kaks identset R ja R 'asendajat) puhul on nimetatud sufiksiga "-dione" molekul..
Lõpuks võib sõna "ketoon" kasutada ka pärast karbonüülrühmaga seotud radikaalide ahelate identifitseerimist.
Aldehüüdide ja ketoonide erinevus
Suurim erinevus aldehüüdide ja ketoonide vahel on vesiniku aatom, mis on seotud aldehüüdide karbonüülrühmaga..
Sellel aatomil on oluline mõju molekuli kaasamisel oksüdatsioonireaktsioonile: aldehüüd moodustab karboksüülhappe või karboksüülhappe soola sõltuvalt sellest, kas oksüdatsioon toimub happelistes või aluselistes tingimustes..
Seevastu ketoonil ei ole seda vesinikku, seega ei toimu oksüdeerimiseks vajalikke minimaalseid astmeid.
On meetodeid ketooni oksüdeerimiseks (oksüdeerivate ainetega, mis on palju võimsamad kui tavaliselt kasutatavad), kuid need murdavad ketooni molekuli, eraldades selle kõigepealt kaheks või enamaks osaks.
Kasutatakse tööstus- ja igapäevaelu
Tööstuses vaadeldakse parfüümides ja värvides sageli ketoneid, võttes arvesse stabilisaatoreid ja säilitusaineid, mis takistavad segu teiste komponentide lagunemist; neil on lisaks ravimitele ka laia spektriga lahustid nendes tööstusharudes, mis toodavad lõhkeaineid, värve ja tekstiile.
Atsetoon (väikseim ja lihtsaim ketoon) on kogu maailmas tuntud lahusti, mida kasutatakse värvieemaldaja ja -lahustina..
Looduses võivad ketoonid esineda suhkruna, mida nimetatakse ketoosideks. Ketoosid on monosahhariidid, mis sisaldavad ühte ketooni molekuli kohta. Kõige tuntum ketoos on fruktoos, puuviljades leiduv suhkur ja mesi.
Loomsete rakkude tsütoplasmas esinev rasvhappe biosüntees esineb ka ketoonide toimel. Lõpuks ja nagu ülalpool mainitud, võib pärast tühja kõhuga või diabeetikutel esineda veres ketoonide tõus.
Ketoonide näited
Butanoon (C4H8O)
Tuntud ka kui MEK (või MEC), toodetakse seda vedelikku tööstuses suurtes kogustes ja seda kasutatakse lahustina.
Tsükloheksanoon (C6H10O)
Massiivses mahus toodetud ketooni kasutatakse sünteetilise nailonmaterjali lähteainena.
Testosteroon (C) |19H22O2)
See on meessugu ja anaboolse steroidi peamine hormoon, mida leidub enamikus selgroogsetes.
Progesteroon (C21H30O2)
Endogeenne steroid ja suguhormoon, mis on seotud menstruaaltsükli, raseduse ja embrüogeneesiga inimestel ja muudel liikidel.
Viited
- Wikipedia. (s.f.). Ketoon Välja otsitud aadressilt en.wikipedia.org
- Britannica, E. (s.f.). Ketoon Välja otsitud britannica.com-st
- Ülikool, M. S. (s.f.). Aldehüüdid ja ketoonid. Välja otsitud chemistry.msu.edu
- ChemGuide. (s.f.). Aldehüüdide ja ketoonide tutvustamine. Välja otsitud aadressilt chemguide.co.uk
- Calgary, U. O. (s.f.). Ketoonid. Välja otsitud aadressilt chem.ucalgary.ca


