Butino struktuur, omadused ja kasutusalad
The butino on keemiline ühend, mis kuulub alküünide rühma, mida iseloomustab peamiselt struktuur, millel on vähemalt kolm sidet kahe süsinikuaatomi vahel..
Alüniinide nimiväärtuse kehtestamise reeglite kehtestamisel on IUPAC (akronüüm inglise keeles International Union of Pure and Applied Chemistry) kindlaks teinud, et neid kasutatakse samamoodi nagu alkeenide puhul..

Mõlema ainetüübi nomenklatuuri põhiliseks erinevuseks on see, et sufiks - üks muudetakse - või siis, kui tegemist on ühenditega, mille struktuuris on kolmiksidet..
Teisest küljest koosneb butino ainult süsinikust ja vesinikust ning see on kahes vormis: 1-butiin, mis on gaasilises faasis standardrõhu ja temperatuuri tingimustes (1 atm, 25 ° C); ja 2-butino, mis on keemilise sünteesi teel tekkinud vedelas faasis.
Indeks
- 1 Keemiline struktuur
- 1.1 1-butino
- 1.2 2-butüün
- 2 Atribuudid
- 3 Kasutamine
- 4 Viited
Keemiline struktuur
Butino tuntud molekulis esitatakse positsiooni struktuurne isomerisatsioon, mis koosneb samade funktsionaalrühmade olemasolust mõlemas ühendis, kuid igaüks neist on ahela erinevas kohas..
Sel juhul on mõlemal butino vormil identne molekulaarne valem; 1-butüülis paikneb aga kolmikside esimeses süsinikuarvus, samas kui 2-butiinis leidub see number kaks. See muudab need asendisomeerideks.
Kolmekordse sideme asukoha tõttu 1-butüüni struktuuri ühes otsas loetakse seda terminaalseks alküüniks, samas kui kolmekordse sideme vahepositsioon 2-butüünistruktuuris annab sellele sisemise alküüni klassifikatsiooni..
Seega võib ühendus olla ainult esimese ja teise süsiniku (1-butüün) või teise ja kolmanda süsiniku (2-butüün) vahel. See on tingitud rakendatavast nomenklatuurist, kus madalaima võimaliku nummerdusega antakse alati kolmiksideme positsioon.
1-butino
Ühend, mida nimetatakse 1-butüüniks, on tuntud ka kui etüülatsetüleen, selle struktuuri ja selle nelja süsinikuaatomi paigutamise ja sidumise tõttu. Kuid rääkides butino viidatakse ainult sellele keemilisele liigile.
Selles molekulis leidub kolmiksidet terminaalses süsinikus, mis võimaldab saada vesinikuaatomeid, mis annavad talle suure reaktiivsuse.
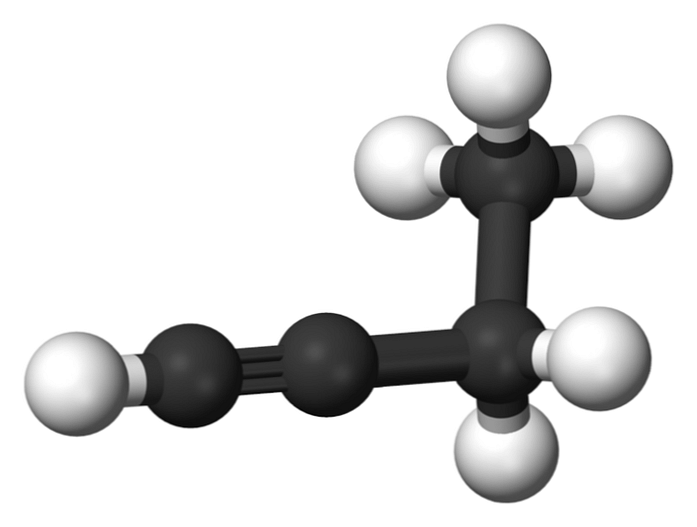
See jäik ja tugev side kui süsinikuaatomite vaheline üksik- või kaksikside tagab stabiilse 1-butüüni lineaarse geomeetria konfiguratsiooni.
Teisest küljest on see gaasiline aine küllaltki tuleohtlik, nii et kuumuse korral võib see kergesti põhjustada tulekahjusid või plahvatusi ja tal on suur reaktiivsus õhu või vee juuresolekul..
2-butüün
Kuna sisemistel alküünidel on suurem stabiilsus kui terminaalsed alkünid, võimaldavad nad 1-butüüni transformatsiooni 2-butüüniks.
See isomerisatsioon võib toimuda 1-butüüni kuumutamisel aluse (nagu NaOH, KOH, NaOCH3 ...) juuresolekul või 1-butüüni ümberpaigutamisega kaaliumhüdroksiidi (KOH) lahuses etanoolis (C2H6O).
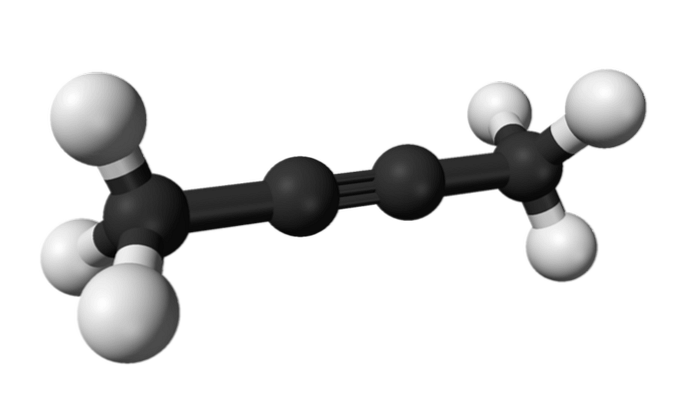
Samamoodi nimetatakse 2-butüünina tuntud kemikaali ka dimetüülatsetüleeniks (või krotonüleeniks), mis kujutab endast vedelat ja lenduvat liiki, mis pärineb kunstlikult.
2-butüülis on kolmikside molekuli keskel, andes talle suurema stabiilsuse kui selle isomeer.
Lisaks sellele on selle värvitu ühendi tihedus veest madalam, kuigi seda peetakse selles lahustumatuks ja tal on kõrge süttivus.
Omadused
-Butino struktuurivalem (sõltumata sellest, milline isomeer on viidatud) on C4H6, millel on lineaarne struktuur.
-Üks keemilistest reaktsioonidest, mida kannab butiinimolekul, on isomerisatsioon, kus molekulis toimub kolmiksideme ümberkorraldamine ja migratsioon..
-1-Butyne on gaasifaasis, väga tuleohtlik ja tihedam kui õhk.
-See aine on samuti üsna reaktiivne ja soojuse juuresolekul võib see põhjustada vägivaldseid plahvatusi.
-Lisaks, kui see värvitu gaas põleb ebapiisavalt, võib see põhjustada süsinikmonooksiidi (CO).
-Kui mõlemad isomeerid puutuvad kokku kõrge temperatuuriga, võivad nad kogeda plahvatusohtlikke polümerisatsioonireaktsioone.
-2-butüün on vedelas faasis, kuigi seda peetakse samuti normaalsetes rõhu- ja temperatuuritingimustes üsna tuleohtlikuks.
-Need ained võivad kogeda tugevaid reaktsioone tugevate oksüdeerivate ainete juuresolekul.
-Samamoodi tekivad redutseerivate liikide juuresolekul eksotermilised reaktsioonid, mille tagajärjel vabaneb gaasiline vesinik..
-Teatud katalüsaatoritega (nt mõned happelised ained) või starteriga kokkupuutel võivad eksotermilised polümerisatsioonireaktsioonid tekkida..
Kasutamine
Kuna neil on erinevad omadused, võivad mõlemal isomeeril olla erinevad kasutusalad ja rakendused, nagu allpool näidatud:
Esiteks on väga sageli üks 1-butino kasutusviisideks selle kasutamine vahepealse etapi sünteetilise päritoluga muude ainete tootmisprotsessis..
Teisest küljest kasutatakse seda keemilist ainet kummi ja sellest saadud ühendite töötlevas tööstuses; nagu näiteks, kui soovite saada bensooli.
Samuti kasutatakse seda mitmesuguste plasttoodete tootmisprotsessis, samuti paljude suure tihedusega polüetüleenainete valmistamisel..
Samuti kasutatakse mõningate metalli sulamite, sealhulgas terase (raua sulam ja süsinik) lõikamiseks ja keevitamiseks sageli 1-butüüni..
Teises mõttes kasutatakse 2-butüüni isomeeri kombinatsioonis mõne teise alküüniga, mida nimetatakse propüüniks, mõnede alküülitud hüdrokinoonidena tuntud ainete sünteesimisel, kui viiakse läbi a-tokoferooli (E-vitamiini) täieliku sünteesi protsess.
Viited
- Wikipedia. (s.f.). Butyne Välja otsitud aadressilt en.wikipedia.org
- Yoder, C. H., Leber P. A. ja Thomsen, M. W. (2010). Sild orgaanilise keemia juurde: mõisted ja nomenklatuur. Välja otsitud aadressilt books.google.co.ve
- Study.com. (s.f.). Butyne: struktuurivalem ja isomeerid. Saadud uuringust.
- PubChem. (s.f.). 1-Butyne. Välja otsitud aadressilt pubchem.ncbi.nlm.nih.gov
- PubChem. (s.f.). 2-Butyne. Välja otsitud aadressilt pubchem.ncbi.nlm.nih.gov


