Naatriumbromiid (NaBr) keemiline struktuur, omadused ja kasutusalad
The naatriumbromiid on keemiline aine, mis kuulub anorgaanilise päritoluga sooladesse. Selle struktuur koosneb bromo halogeenist ja naatriummetalli elemendist 1: 1. Selle keemiline valem on NaBr ja on stabiilse agregatsiooni tingimustes standardsetes temperatuuri- ja rõhutingimustes (25 ° C ja 1 atm)..
Tavaliselt võib seda täheldada valge pulbrina ja seda peetakse kristalset tüüpi ühendiks, mis avaldab ka hügroskoopset käitumist; see tähendab, et tal on võime imada niiskust oma ümbrusest.

Samamoodi on naatriumbromiidil füüsikalised omadused, mis on väga sarnased sama metalli: naatriumkloriidi teise ioonse ühendiga. See kloriid on esindatud kui NaCl, mida tuntakse sagedamini tavalise soolana või lauasoolana.
Sellel on suur hulk kasutusviise teaduse erinevates valdkondades; näiteks kasutatakse seda mitmesuguste ravimite (sedatiivide, uinutite, krambivastaste ainete) tootmisel, samuti orgaanilises sünteesis ja isegi fotograafias..
Indeks
- 1 Keemiline struktuur
- 1.1 Keemiline süntees
- 2 Atribuudid
- 3 Kasutamine
- 4 Viited
Keemiline struktuur
Nagu eelnevalt mainitud, esineb naatriumbromiid tahkes faasis ja sarnaselt paljude teiste anorgaanilise iseloomuga sooladega on kristalliline struktuurne konformatsioon.
Sellel kristallilisel molekulil, mis koosneb broomiaatomist ja vesinikuaatomist, on kuubikujulise kuju, mis on keskendatud nägudele, nagu sama metalli haloidsed soolad (NaI, NaF ja NaCl)..
See molekulaarne paigutus moodustab paljude ühendite struktuurilise aluse, milles tellimine viiakse läbi nii, et iga ioon hoitakse oktaeedrilise jooni keskel, nagu on näidatud järgmises pildis..
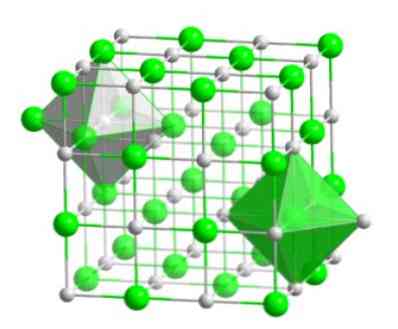
Seda tüüpi kristallides näete, kuidas iga ioonil on ümber kuus muud iooni, millel on vastupidine elektrilaeng, mis asuvad oktaeedrilise jooni otstes.
Samuti eeldab selle ioonse aine struktuur, et sellel on kõrge sulamistemperatuur umbes 747 ° C, olles kaubanduslikult kahes vormis: veevaba liik (ilma veemolekulideta) ja dihüdraaditud liigid (kahe veemolekuliga selle pinnal). Struktuurivalem (NaBr · 2H2O)), mille sulamispunktid on erinevad.
Keemiline süntees
Naatriumbromiidi põhjustab vesinikbromiidi (BrH, vesinikhalogeniidi gaasifaasis) ja naatriumhüdroksiidi (NaOH, tugev alus tahkes faasis ja hügroskoopsete omadustega) keemiline reaktsioon..
Sel viisil valmistatakse see kaubanduslikult, lisades NaOH lahusele liiaga broomi. See moodustab bromiidi / broomi segu. Järgnevalt aurustatakse saadud produktid kuivamiseni ja töödeldakse süsinikuga, et saada bromaadi ioon (BrO) redutseerimisreaktsioon.3-) bromiidi ioonile (Br-).
Neutraliseerimine
Sarnaselt võib seda anorgaanilist soola valmistada ka naatriumkarbonaadi neutraliseerimisreaktsiooni (Na2CO3) bromiidhappega (HBrO)3), järgides eespool kirjeldatud protseduuri.
Sünteesi kaudu võib seda ainet valmistada raua ja broomi ja vee vahelise reaktsiooni abil. Selle reaktsiooni produktina on pärit raud (II) bromiidi liigid.
Seejärel moodustati see liik (esindatud FeBr-ga)2/ FeBr3) lahustatakse vees ja lisatakse teatud kogus naatriumkarbonaati. Lõpuks filtreeritakse lahus ja viiakse läbi aurustamisprotsess, et lõpuks saada naatriumbromiid.
Omadused
- Tavaliselt leidub see tahke agregatsiooni olekus valge pulbri kujul.
- Sellel on kristalne struktuur, kuubikujulise molekulaarse paigutusega, mis on keskendatud näodele.
- Selle aine sulamistemperatuur on veevaba vormi puhul umbes 747 ° C ja dihüdreeritud vormi puhul 36 ° C, mis näitab lagunemist enne selle sulamist.
- See koosneb naatriumioonist (Na+) ja bromiidi ioon (Br-), mille molaarmass või molekulmass on 102,89 g / mol.
- Selle keemistemperatuur on üsna kõrge, mida täheldatakse temperatuuril 1390 ° C (vastab 2530 ° F või 1660 K)..
- Selle liigi lahustuvus on umbes 94,32 g / 100 ml 25 ° C juures vees, kasvades temperatuuri tõusuga.
- Kuumutades selleni, et see laguneb, vabastab see aine broomi ja naatriumoksiidi gaase, mida peetakse toksilisteks.
- Naatriumbromiidi veevaba vormi tihedus on 3,21 g / cm3, samas kui dihüdraatühendi 2,18 g / cm3.
- Selle lahustuvust alkoholis peetakse mõõdukaks, nagu ka teistes lahustites nagu püridiin, ammoniaak ja hüdrasiin.
- See on lahustumatu atsetonitriili ja atsetooni suhtes.
Kasutamine
- Meditsiinivaldkonnas kasutatakse seda ravimina paljude haiguste korral, mis põhjustavad krampe ja ravi epilepsia ärahoidmiseks Wolf-Hirschhorni sündroomiga patsientidel, samuti rahustavates ja hüpnootilistes ravides..
- Veterinaarmeditsiinis kasutatakse koertel, kellel esineb krambihäireid selliste ravimite nagu fenobarbitaali või primidooni kõrvaltoimete tõttu..
- Naftatööstuse valdkonnas kasutatakse seda teatud tihedusega erineva tihedusega vedelike ettevalmistamisel, mida kasutatakse naftakaevudes.
- Bioloogiliste uuringute valdkonnas on tõestatud selle mikrobiotsiidsed omadused; see tähendab, et seda kasutatakse erinevate tüüpi bakterite arengu kontrollimiseks.
- Teatud orgaanilise tüüpi sünteesides kasutatakse seda anorgaanilist laadi soola teiste broomi moodustavate liikide valmistamiseks. Näiteks Finkelsteini reaktsiooni abil saadakse mõned suurema reaktsioonivõimega alküülhalogeniidid, millest üks oli varem kasutatud fotograafias..
- Puhastamise ja desinfitseerimise valdkonnas kasutatakse naatriumbromiidi koos klooriga suurte veekoguste, näiteks basseinide ja mullivannide puhastamiseks..
Viited
- Wikipedia. (s.f.). Naatriumbromiid. Välja otsitud aadressilt en.wikipedia.org
- PubChem. (s.f.). Naatriumbromiid. Välja otsitud aadressilt pubchem.ncbi.nlm.nih.gov
- Johnson, A. W. (1999). Kutse orgaanilisele keemiale. Välja otsitud aadressilt books.google.co.ve
- Science Direct. (s.f.). Naatriumbromiid. Välja otsitud aadressilt sciencedirect.com
- Riviere, J. E. ja Papich, M. G. (2009). Veterinaarfarmakoloogia ja terapeutika. Välja otsitud aadressilt books.google.co.ve


