Keemiliste võrrandite meetodite ja näidete tasakaalustamine
The keemiliste võrrandite tasakaalustamine tähendab, et kõigil nimetatud võrrandis olevatel elementidel on mõlemal küljel sama aatomite arv. Selle saavutamiseks on vaja kasutada tasakaalustamismeetodeid stöhhiomeetriliste koefitsientide määramiseks, mis sobivad igale reaktsioonis leiduvale liigile..
Keemiline võrrand on sümbolite abil, mis toimub kahe või enama aine keemilise reaktsiooni käigus. Reagentid suhtlevad üksteisega ja sõltuvalt reaktsioonitingimustest saadakse üks või mitu erinevat ühendit..
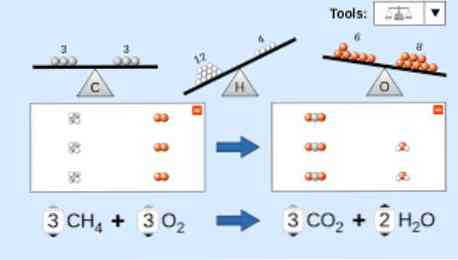
Keemilise võrrandi kirjeldamisel tuleb arvesse võtta järgmist: Esiteks, reagentide ained kirjutatakse võrrandi vasakpoolsele küljele, millele järgneb ühesuunaline nool või kaks vastupidist horisontaalset noolt, sõltuvalt teostatava reaktsiooni tüübist. köis.
Indeks
- 1 Keemiliste võrrandite tasakaalustamise meetodid
- 1.1 Keemiliste võrrandite tasakaalu katse ja eksituse teel (nimetatakse ka kontrollimise või kohtuprotsessina)
- 1.2 Keemiliste võrrandite algebraline tasakaalustamine
- 1.3 Redoxi võrrandite rullimine (ioon-elektroni meetod)
- 2 Näited keemiliste võrrandite tasakaalustamisest
- 2.1 Esimene näide
- 2.2 Teine näide
- 2.3 Kolmas näide
- 3 Viited
Keemiliste võrrandite tasakaalustamise meetodid
Lähtudes sellest, et reaktiivid ja tooted on teada ning et nende valemid on õigesti väljendatud neile vastavale küljele, jätkame võrrandite tasakaalustamist järgmiste meetodite kohaselt..
Keemiliste võrrandite tasakaalustamine katse ja eksituse teel (nimetatakse ka kontrollimise või kohtuprotsessiga)
See põhineb reaktsiooni stöhhiomeetrial ja püüab võrrandi tasakaalustamiseks proovida erinevaid koefitsiente, seni kuni valitakse väikseimad võimalikud täisarvud, mille abil saadakse mõlema elemendi mõlema elemendi sama aatomite arv reaktsioonist.
Reagendi või toote koefitsient on selle valemile eelnev arv ja see on ainus number, mida saab võrrandi tasakaalustamisel muuta, kuna valemite alamkirjade muutmine muudaks ühendi identiteeti kõne all.
Loe ja võrrelge
Pärast iga reaktsiooni elemendi tuvastamist ja selle õigele küljele laskmist jätkame iga võrrandis sisalduva elemendi aatomite arvu loendamist ja võrdlemist ning määrame need, mis peavad olema tasakaalustatud.
Seejärel jätkame iga elemendi tasakaalustamist (üks korraga), asetades igale valemile, mis sisaldab tasakaalustamata elemente, kõik koefitsiendid. Tavaliselt on metallelemendid kõigepealt tasakaalustatud, seejärel mittemetalsed elemendid ja lõpuks hapniku- ja vesinikuaatomid.
Sel viisil korrutab iga koefitsient eelmise valemi kõiki aatomeid; nii et elementi tasakaalustades võivad teised tasakaalustamatust tekitada, kuid seda korrigeeritakse, kui reaktsioon on tasakaalus.
Lõpuks kinnitab seda viimane arv, et kogu võrrand on õigesti tasakaalustatud, see tähendab, et see järgib materjali säilitamise seadust.
Keemiliste võrrandite algebraline tasakaalustamine
Selle meetodi kasutamiseks luuakse protseduur keemiliste võrrandite koefitsientide käsitlemiseks, mida tuleb lahendada süsteemi tundmatutena..
Esiteks võetakse võrdluseks konkreetne reaktsiooni element ja koefitsiendid paigutatakse tähtedeks (a, b, c, d ...), mis esindavad tundmatuid aineid vastavalt selle elemendi olemasolevatele aatomitele igas molekulis (kui liik ei sisalda seda elementi "0").
Pärast esimese võrrandi saamist määratakse reaktsioonis olevate teiste elementide võrrandid; seal on nii palju võrrandeid, kui nimetatud reaktsioonis on elemente.
Lõpuks, tundmatud on määratud ühe algebralise redutseerimise, tasandamise või asendamise meetodi abil ning saadakse koefitsiendid, mis annavad tulemuseks õigesti tasakaalustatud võrrandi.
Redoxi võrrandite tasakaalustamine (ioon-elektroni meetod)
Kõigepealt pannakse üldine (tasakaalustamata) reaktsioon oma ioonvormile. Siis on see võrrand jagatud kaheks poolreaktsiooniks, oksüdatsiooniks ja vähendamiseks, iga tasakaalustamine vastavalt aatomite arvule, nende tüübile ja nende tasudele..
Näiteks lisatakse happelises keskkonnas esinevate reaktsioonide jaoks H-molekule.2Või hapniku aatomite tasakaalustamiseks ja H lisamiseks+ vesiniku aatomite tasakaalustamiseks.
Seevastu leeliselises keskkonnas lisatakse võrdne arv OH ioone- iga H-iooni võrrandi kahel poolel+, ja kus H ioonid tekivad+ ja OH- nad tulevad kokku H-molekulide moodustamiseks2O.
Lisage elektronid
Siis peate lisama tasude tasakaalustamiseks nii palju elektrone, kui see on vajalik, pärast iga poolreaktsiooni tasakaalustamist.
Pärast iga poolreaktsiooni veeremist lisatakse need ja kulminiseeritakse lõpliku võrrandi tasakaalustamine katse ja vea abil. Kui kahe poolreaktsiooni elektronide arv on erinev, tuleb üks või mõlemad korrutada selle numbriga võrdse koefitsiendiga.
Lõpuks tuleb kinnitada, et võrrand sisaldab sama arvu aatomeid ja sama tüüpi aatomeid lisaks sellele, et neil on samad tasud globaalse võrrandi mõlemal poolel.
Näited keemiliste võrrandite tasakaalustamisest
Esimene näide
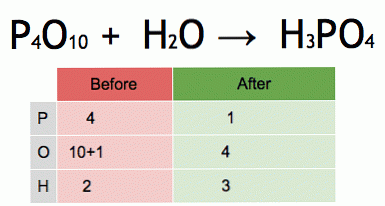
See on tasakaalustatud keemilise võrrandi animatsioon. Fosforpentoksiid ja vesi muundatakse fosforhappeks.
P4O10 + 6 H20 → 4 H3PO4 (-177 kJ).
Teine näide
Sul on etaani põlemisreaktsioon (tasakaalustamata).
C2H6 + O2 → CO2 + H2O
Kasutades katse ja vea meetodit selle tasakaalustamiseks, on täheldatud, et ühelgi elemendil ei ole võrrandi mõlemal poolel sama arvu aatomeid. Seega algab see süsiniku tasakaalu järgi, lisades stoikiometrilise koefitsiendina kaks, mis kaasneb sellega toodete küljel..
C2H6 + O2 → 2CO2 + H2O
Süsinik on mõlemal poolel tasakaalus, seega jätkame vesiniku tasakaalustamist, lisades veemolekule kolm.
C2H6 + O2 → 2CO2 + 3H2O
Lõpuks, kuna võrrandi paremal küljel on seitse hapniku aatomit ja see on viimane tasakaalustamata element, siis hapniku molekuli ette paigutatakse fraktsionaalne number 7/2 (kuigi üldiselt on eelistatud terved koefitsiendid)..
C2H6 + 7 / 2O2 → 2CO2 + 3H2O
Seejärel kontrollige, kas võrrandi kummalgi küljel on sama arv süsinikuaatomeid (2), vesinikku (6) ja hapnikku (7)..
Kolmas näide
Raua oksüdeerumine dikromaatioonidega toimub happelises keskkonnas (tasakaalustamata ja ioonsel kujul)..
Usk2+ + Kr2O72- → Usk3+ + Kr3+
Kasutades ioon-elektroni meetodit selle tasakaalustamiseks, jagatakse see kaheks poolreaktsiooniks.
Oksüdatsioon: usk2+ → Usk3+
Vähendamine: Cr2O72- → Kr3+
Kuna raua aatomid on juba tasakaalustatud (1: 1), lisatakse toodete küljele laengu tasakaalustamiseks elektron.
Usk2+ → Usk3+ + e-
Nüüd on Cr aatomid tasakaalustatud, lisades võrrandi paremale küljele kaks. Seejärel, kui reaktsioon toimub happelises keskkonnas, lisatakse seitse H-molekuli.2Või toodete küljel hapniku aatomite tasakaalustamiseks.
Kr2O72- → 2Cr3+ + 7H2O
H-aatomite tasakaalustamiseks lisatakse 14 H-iooni+ reagentide küljel ja pärast materjali võrdsustamist tasakaalustatakse laenguid kuue elektroni lisamisega samal küljel.
Kr2O72- +14H+ + 6e- → 2Cr3+ + 7H2O
Lõpuks lisatakse mõlemad poolreaktsioonid, kuid kuna oksüdatsioonireaktsioonis on ainult üks elektron, tuleb see kõik korrutada kuuega.
6Fe2+ + Kr2O72- +14H+ + 6e- → Usk3+ + 2Cr3+ + 7H2O + 6e-
Lõpuks tuleb elektronid kõrvaldada globaalse ioonivõrrandi mõlemalt poolt, kontrollides, et nende laeng ja aine on õigesti tasakaalustatud.
Viited
- Chang, R. (2007). Keemia (9. väljaanne). McGraw-Hill.
- Hein, M. ja Arena, S. (2010). Kolledži keemia alused, asendusliige. Välja otsitud aadressilt books.google.co.ve
- Tuli, G. D. ja Soni, P. L. (2016). Keemia või keemiliste võrrandite keel. Välja otsitud aadressilt books.google.co.ve
- Kiire kirjastamine (2015). Keemia võrrandid ja vastused (Speedy Study Guides). Välja otsitud aadressilt books.google.co.ve


