Bohri karakteristikute aatomi mudel, postulaadid, piirangud
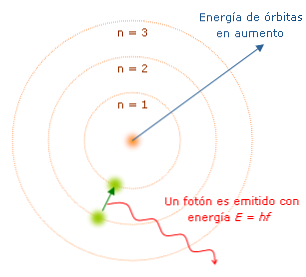
The Bohri aatomi mudel on taani füüsiku Neils Bohri (1885-1962) poolt välja pakutud aatom. Mudel ütleb, et elektron liigub orbiidil kindlaksmäratud vahemaa ümber aatomituuma, kirjeldades ühtlast ümmargust liikumist. Orbiidid - või energia tasemed, nagu ta neid nimetas, on erineva energiaga.
Iga kord, kui elektron muutub orbiidil, kiirgab või neelab energia kindlaksmääratud kogustes, mida nimetatakse "kvantiks". Bohr selgitas vesiniku aatomi poolt eralduva (või neeldunud) valguse spektrit. Kui elektron liigub ühest orbiidist teise tuuma suunas, tekib energia ja valguse kadu, mille lainepikkus ja energiaomadused on.

Bohr nummerdas elektroni tasemed, arvestades, et mida lähemal on elektron elektroni tuumale, seda madalam on selle energiaolek. Sel moel, seda kaugemal elektron on tuumast, seda kõrgem on energia taseme number ja seetõttu on energia olek suurem.
Indeks
- 1 Peamised omadused
- 1.1 See põhineb muudel aja mudelitel ja teooriatel
- 1.2 Eksperimentaalsed tõendid
- 1.3 Elektronid eksisteerivad energia tasemel
- 1.4 Ilma energiata ei ole elektroni liikumist
- 1.5 Elektronide arv igas kihis
- 1.6 Elektroonid pöörlevad ringjoontes ilma kiirgavat energiat
- 1.7 Lubatud orbiidid
- 1.8 Hüppedest eraldunud või neeldunud energia
- 2 Bohri aatomi mudeli postulaadid
- 2.1 Esimene postulaat
- 2.2 Teine postulaat
- 2.3 Kolmas postulaat
- 3 Vesiniku aatomite energiataseme diagramm
- 4 Bohri mudeli kolm peamist piirangut
- 5 Huvitavad artiklid
- 6 Viited
Peamised omadused
Bohr-mudeli omadused on olulised, sest nad määrasid tee täielikuma aatomi mudeli väljatöötamiseks. Peamised neist on:
See põhineb muudel aja mudelitel ja teooriatel
Bohri mudel oli esimene, mis sisaldas Rutherfordi aatomi mudeli toetatud kvantteooriat ja Albert Einsteini fotoelektrilisest mõjust võetud ideid. Tegelikult olid Einstein ja Bohr sõbrad.
Eksperimentaalsed tõendid
Selle mudeli kohaselt absorbeerivad või kiirgavad aatomid kiirgust ainult siis, kui elektronid hüppavad lubatud orbiidide vahel. Saksa füüsikud James Franck ja Gustav Hertz said 1914. aastal nende riikide kohta eksperimentaalsed tõendid.
Elektroone on olemas energia tasemel
Elektronid ümbritsevad tuuma ja eksisteerivad teatud energia tasemel, mis on diskreetsed ja mida on kirjeldatud kvantarvudes.
Nende tasemete energiasisaldus eksisteerib numbri n funktsioonina, mida nimetatakse põhiliseks kvantarvuks, mida saab arvutada võrranditega, mida kirjeldatakse hiljem.
Ilma energiata ei ole elektroni liikumist
Ülaltoodud joonisel on näidatud elektron, mis teeb kvanthüppe.
Selle mudeli kohaselt ei ole ilma energiata elektroni liikumine ühelt tasemelt teisele, nagu ilma energiata ei ole võimalik langetada või kahest magnetist eraldatud objekti üles tõsta..
Bohr soovitas kvoodi kui energiat, mida elektron peab ühelt tasemelt teisele minema. Ta märkis ka, et elektroni madalaimat energiat taset nimetatakse "maaväliseks olekuks". "Ergastatud olek" on ebastabiilsem olek, mis tuleneb elektroni kõrgemale energiakõverale liikumisest.
Elektronide arv igas kihis
Iga kihi jaoks sobivad elektronid arvutatakse 2n-ga2
Keemilistel elementidel, mis on perioodilises tabelis ja mis on samas veerus, on viimases kihis samad elektronid. Esimesel neljal kihil oleks elektronide arv 2, 8, 18 ja 32.
Elektroonid pöörlevad ringikujulistel radadel ilma energiat kiirgamata
Bohri esimese postulaadi kohaselt kirjeldavad elektronid aatomit ümbritsevaid ringikujulisi ringe, ilma et nad kiirgaksid energiat.
Lubatud on orbiidid
Bohri teise postulaadi kohaselt on elektroni ainsad lubatud orbiidid need, mille jaoks elektroni nurkimpulss L on Plancki konstanti täisarvuline kordaja. Matemaatiliselt väljendatakse seda nii:
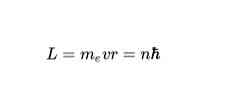
Hüppedest eraldunud või neeldunud energia
Kolmanda postulaadi kohaselt eraldaksid või neelavad elektronid hüppeid ühelt orbiidilt teisele. Orbiidi hüppamisel eraldub või neeldub foton, mille energiat kujutatakse matemaatiliselt:
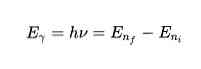
Bohri aatomi mudeli postulaadid
Bohr andis järjepidevuse aatomi planeedimudelile, mille kohaselt elektronid pöördusid positiivselt laetud tuuma ümber, samuti planeedid ümber Päikese.
Kuid see mudel vaidlustab ühe klassikalise füüsika postulaadi. Selle kohaselt peaks elektrilise laenguga (nagu elektron) osakese, mis liigub ringjoont mööda, elektromagnetilise kiirguse kaudu pidevalt kaotama energiat. Energia kaotamisel peaks elektron järgima spiraali, kuni see langeb tuuma.
Seejärel eeldas Bohr, et klassikalise füüsika seadused ei olnud aatomites täheldatud stabiilsuse kirjeldamiseks kõige sobivamad ja esitas järgmised kolm postulaati:
Esimene postulaat
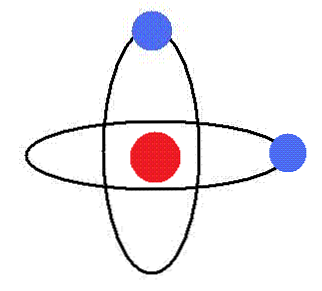
Elektron ringub ringikujulistel ringidel tuuma ümber ilma energiat kiirgamata. Nendes orbiidides on orbitaalnurkne tempo konstantse.
Aatomite elektronide jaoks on lubatud ainult teatud raadiusega orbiidid, mis vastavad teatud kindlaksmääratud energia tasemetele.
Teine postulaat
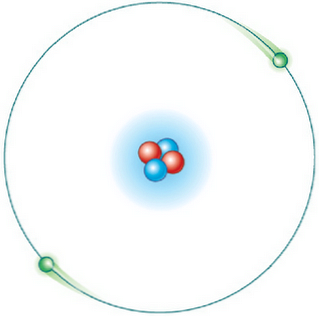
Kõik orbiidid ei ole võimalikud. Aga kui elektron on orbiidil, mis on lubatud, on see spetsiifilise ja püsiva energia olekus ning ei eralda energiat (statsionaarne energiapind).
Näiteks on vesiniku aatomil elektroni lubatud energiad antud järgmise võrrandiga:
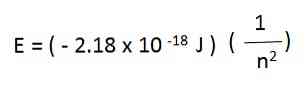
Ülaltoodud võrrandist genereeritud vesinikuaatomi elektronenergia on negatiivne iga n väärtuse suhtes. Kui n suureneb, on energia vähem negatiivne ja seega suureneb.
Kui n on piisavalt suur, näiteks n = ∞ - energia on null ja see näitab, et elektron on vabastatud ja ioniseeritud aatom. See nullenergia olek sisaldab suuremat energiat kui negatiivsete energiatega riigid.
Kolmas postulaat
Elektron võib staatilise energia orbiidilt teisele vahetada, eraldades või neelates energiat.
Väljastatud või neeldunud energia on võrdne kahe riigi vahelise energiaerinevusega. See energia E on fotoni vormis ja selle annab järgmine võrrand:
E = h ν
Selles võrrandis E on energia (neeldunud või emiteeritud), h on Plancki konstant (selle väärtus on 6,63 x 10-34 joule-sekundid [J-s]) ja ν on valguse sagedus, mille ühik on 1 / s.
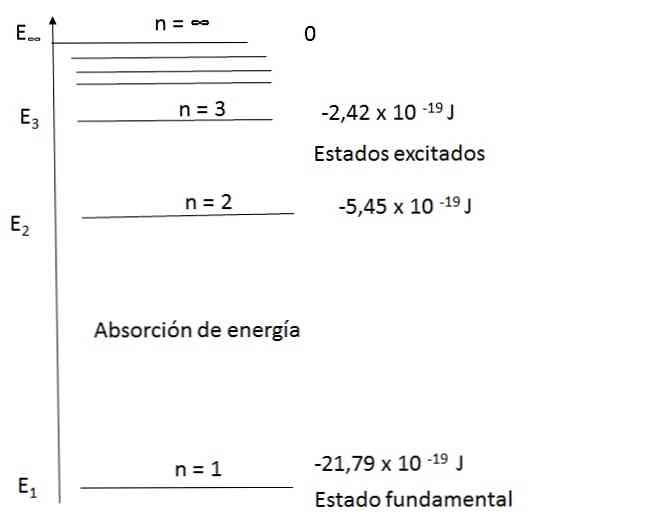
Vesiniku aatomite energiataseme diagramm
Bohr-mudel oli võimeline vesiniku aatomi spektrit rahuldavalt selgitama. Näiteks on nähtava valguse lainepikkuste vahemikus vesinikuaatomi emissioonispekter järgmine:
Vaatame, kuidas arvutada mõnede täheldatud valgusribade sagedus; näiteks punane värv.
Kasutades esimest võrrandit ja asendades n väärtusega 2 ja 3, saad skeemil olevad tulemused.

See on:
N = 2 korral E2 = -5,45 x 10-19 J
N = 3 korral E3 = -2,42 x 10-19 J
Seejärel on võimalik arvutada energia erinevus kahe taseme kohta:
ΔE = E3 - E2 = (-2,42 - (- 5,45)) x 10 - 19 = 3,43 x 10 - 19 J
Vastavalt kolmandas postulaadis selgitatud võrrandile ΔE = h ν. Seejärel saate arvutada ν (valguse sagedus):
ν = ΔE / h
See on:
ν = 3,43 x 10-19 J / 6,63 x 10-34 J-s
ν = 4,56 x 1014 s-1 või 4,56 x 1014 Hz
Olles λ = c / ν ja valguse kiirus c = 3 x 10 8 m / s, lainepikkuse annab:
λ = 6,565 x 10 - 7 m (656,5 nm)
See on vesinikujoonte spektris täheldatud punase riba lainepikkuse väärtus.
Bohri mudeli kolm peamist piirangut
1 - See kohaneb vesinikuaatomi spektriga, kuid mitte teiste aatomite spektritega.
2 - elektroni unduleeruvad omadused ei ole selle kirjelduses esindatud väikese osakese kujul, mis pöörleb ümber aatomituuma.
3 - Bohr ei selgita, miks klassikalist elektromagnetismi tema mudelile ei kohaldata. See tähendab, et miks elektronid ei väljasta elektromagnetkiirgust, kui nad on statsionaarses orbiidis.
Huvitavad artiklid
Schrödingeri aatomimudel.
Broglie aatomi mudel.
Chadwicki aatomimudel.
Heisenbergi aatomimudel.
Perrini aatomi mudel.
Thomsoni aatomimudel.
Daltoni aatomimudel.
Dirac Jordani aatomimudel.
Demokraatide aatomi mudel.
Viited
- Brown, T. L. (2008). Keemia: keskne teadus. Ülem-saduljoon, NJ: Pearson Prentice'i saal
- Eisberg, R., & Resnick, R. (2009). Aatomite, molekulide, tahkete ainete, tuumade ja osakeste kvantfüüsika. New York: Wiley
- Bohr-Sommerfeldi aatomimudel. Välja otsitud andmebaasist: fisquiweb.es
- Joesten, M. (1991). Keemia maailm Philadelphia, Pa.: Saunders College Publishing, lk.76-78.
- Modèle de Bohr de l'atome d'hydrogène. Välja otsitud fr.khanacademy.org
- Izlar, K. Retrospect sur l'atome: Bohri a c. Välja otsitud andmebaasist: home.cern



