Süsiniku aatomi omadused, struktuur, hübridisatsioon, klassifikatsioon
The süsinikuaatom See on ilmselt kõigi elementide kõige olulisem ja sümboolne, sest tänu sellele on elu olemasolu võimalik. See ümbritseb iseenesest mitte ainult mõnda elektroni või prootonite ja neutronite tuuma, vaid ka tähttolmu, mis jõuab sisse ja moodustab elusolendeid..
Samuti leidub maakoores süsinikuaatomeid, kuigi mitte arvukusega, mis on võrreldavad metalliliste elementidega, nagu raud, karbonaadid, süsinikdioksiid, õli, teemandid, süsivesikud jne. selle füüsikalised ja keemilised ilmingud.
Aga kuidas on süsinikuaatom? Esimene ebatäpne skeem on see, mida on näha ülaloleval pildil, mille omadused on kirjeldatud järgmises osas.
Süsiniku aatomid liiguvad läbi atmosfääri, merede, aluspinnase, taimede ja loomaliikide. Selle suur keemiline mitmekesisus tuleneb selle sidemete suurest stabiilsusest ja sellest, kuidas need ruumis tellitakse. Seega on ühelt poolt sile ja määriv grafiit; ja teiselt poolt teemant, mille kõvadus ületab paljude materjalide kõvadust.
Kui süsinikuaatomil ei oleks seda iseloomustavaid omadusi, ei oleks orgaaniline keemia täielikult olemas. Mõned nägijad näevad selles uusi tuleviku materjale allotroopsete struktuuride (süsinik-nanotorud, grafeen, fullereenid jne) kujundamise ja funktsionaliseerimise kaudu..
Indeks
- 1 Süsinikuaatomi omadused
- 2 Struktuur
- 3 Hübridisatsioon
- 3.1 sp3
- 3.2 sp2 ja sp
- 4 Klassifikatsioon
- 4.1 Esmane
- 4.2 Teisene
- 4.3 Kolmanda taseme
- 4.4 Kvaternaar
- 5 Kasutamine
- 5.1 Aatomimassi ühik
- 5.2 Süsinikutsükkel ja elu
- 5.3 13C NMR spektroskoopia
- 6 Viited
Süsinikuaatomi omadused
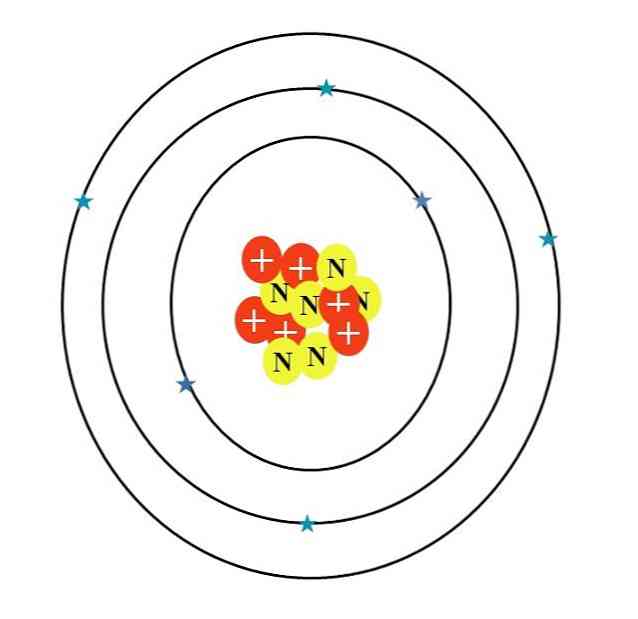
Süsinikuaatomit sümboliseerib täht C. Selle aatomi number Z on 6, seega on sellel kuus prootonit (punased ringid sümboliga "+" tuumas). Lisaks sellele on sellel kuus neutronit (kollased ringid tähega "N") ja lõpuks kuus elektroni (sinised tähed).
Nende aatomiosakeste masside summa annab keskmise väärtuse 12,0107 u. Siiski vastab pildi aatom 12-süsiniku isotoopile (12C), mis koosneb d. Muud isotoopid, näiteks 13C ja 14C, mis on vähem rikkalik, erineb ainult neutronite arvust.
Niisiis, kui sa neid isotoope joonistad 13C-l oleks veel kollane ring ja 14C, veel kaks. See tähendab loogiliselt, et nad on raskemad süsinikuaatomid.
Lisaks sellele, milliseid muid omadusi selles osas võib mainida? See on tetravalentne, st see võib moodustada neli kovalentset võlakirja. See asub perioodilise tabeli rühmas 14 (käibemaks), täpsemalt plokis p.
Samuti on see väga mitmekülgne aatom, mis on võimeline siduma peaaegu kõigi perioodilise tabeli elementidega; eriti iseendaga, moodustades makromolekule ja lineaarseid, hargnenud ja lamellpolümeere.
Struktuur
Mis on süsinikuaatomi struktuur? Sellele küsimusele vastamiseks tuleb kõigepealt minna oma elektroonilisse konfiguratsiooni: 1s22s22p2 või [He] 2s22p2.
Seetõttu on kolm orbitaali: 1s2, 2s2 ja 2p2, mõlemal on kaks elektroni. Seda võib näha ka ülaltoodud pildist: kolm rõngast, millel on kaks elektroni (sinised tähed), igaüks (ärge segage rõngaid ringi: nad on orbitaalsed).
Pange tähele, et kahel tähest on tumedam sinise toon kui ülejäänud neli. Miks? Kuna esimesed kaks vastavad sisekihile 1s2 või [Ta], kes ei osale otseselt keemiliste sidemete moodustamisel; kui väliskihis olevad elektronid, 2s ja 2p, teevad seda.
S ja p orbitaalidel ei ole sama kuju, nii et illustreeritud aatom ei ole reaalsus; lisaks elektronide ja tuumade vahelisele kaugusele, mis peaks olema sadu kordi suurem.
Seetõttu koosneb süsinikuaatomi struktuur kolmest orbitaalist, kus elektronid "sulavad" hajutatud elektroonilisteks pilvedeks. Ja tuumade ja nende elektronide vahel on kaugus, mis võimaldab meil pilguheitesse tuua tohutu "tühjus" aatomi sees.
Hübridisatsioon
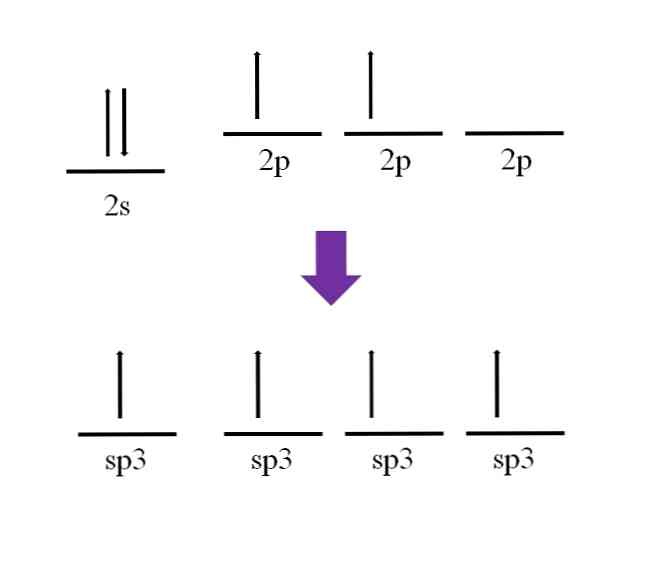
Varem mainiti, et süsinikuaatom on tetravalentne. Vastavalt selle elektroonilisele konfiguratsioonile on selle 2s elektronid seotud ja 2p elektronid on paaritu:
Jääb kasutatav p orbitaal, mis on tühi ja täidetakse täiendava elektroniga lämmastikuaatomis (2p3).
Vastavalt kovalentse sideme määratlusele on vajalik, et iga aatomi moodustaks selle moodustamiseks elektroni; Seda võib siiski täheldada basaalolek süsinikuaatomist, on see vaevalt kaks mitteseotud elektroni (üks igas 2p orbiidis). See tähendab, et selles olekus on see kahevalentne aatom ja seetõttu moodustab see ainult kaks sidet (-C-).
Niisiis, kuidas on võimalik, et süsinikuaatom moodustab neli võlakirja? Selleks peate edendama elektroni 2s orbitaalsest 2p kõrgemale energia orbiidile. See on tehtud, neli tulemuseks olevat orbitaali on degenereerunud; teisisõnu, neil on sama energia või stabiilsus (arvestage, et need on joondatud).
Seda protsessi nimetatakse hübridiseerimiseks ja tänu sellele on süsinikuaatomil neli orbitaalset sp3 ühe elektroniga moodustatakse neli linki. Selle põhjuseks on selle iseloomulik tetravalentsus.
sp3
Kui süsinikuaatomil on sp-hübridisatsioon3, Orienteerige oma neli hübriid-orbitaali tetraeedri tippudesse, milleks on selle elektrooniline geomeetria.
Nii saate tuvastada süsiniku sp3 sest see moodustab ainult neli lihtsaid sidemeid, nagu metaani molekulis (CH4). Ja selle ümber võib täheldada tetraedrilist keskkonda.
Sp orbitaalide kattumine3 see on nii efektiivne ja stabiilne, et lihtsa C-C sideme entalpia on 345,6 kJ / mol. See selgitab, miks on olemas lõputud süsiniku struktuurid ja mõõtmatu arv orgaanilisi ühendeid. Lisaks võivad süsinikuaatomid moodustada muud tüüpi võlakirju.
sp2 ja sp
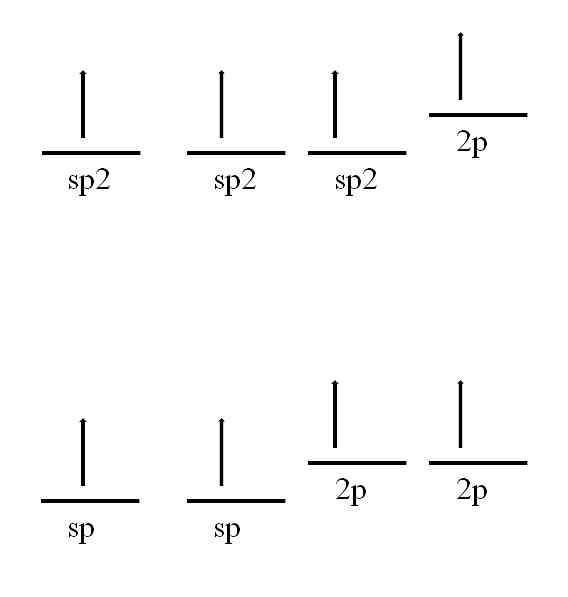
Süsinikuaatom on samuti võimeline vastu võtma teisi hübridisatsioone, mis võimaldavad moodustada topelt- või isegi kolmiksideme.
Sp. Hübridisatsioonis2, Nagu pildist näha, on kolm sp orbitaali2 degenereeritud ja 2p orbitaal jääb muutumatuks või "puhtaks". Kolme sp orbitaaliga2 eraldatud 120 °, moodustab süsiniku kolmekordse sideme trigonaalse tasapinna elektroonilise geomeetria abil; samal ajal kui 2p orbiidiga, mis on risti teiste kolme poole, moodustab see sideme π: -C = C-.
Sp-hübridisatsiooni puhul on kaks sp orbitaali eraldatud 180º, nii et nad joonistavad lineaarse elektroonilise geomeetria. Seekord on neil kaks üksteise suhtes risti asetsevat puhta 2p orbitaali, mis võimaldavad süsinikul moodustada kolmiksidemeid või kahte kaksiksidet: -C = C- või · C = C = C ·· (tsentraalne süsinik on hübridisatsioon) ).
Pange tähele, et alati (tavaliselt), kui lisate süsiniku ümber lingid, leiad, et number on neli. See teave on oluline Lewise struktuuride või molekulaarstruktuuride joonistamisel. Teoreetiliselt ja eksperimentaalselt vastuvõetamatu on süsinikuaatom, mis moodustab viis sidet (= C≡C).
Klassifikatsioon
Kuidas klassifitseeritakse süsinikuaatomid? Enam kui sisemiste omaduste järgi klassifitseerimine sõltub tegelikkuses molekulaarsest keskkonnast. See tähendab, et molekulis võib selle süsinikuaatomeid klassifitseerida vastavalt järgnevale.
Esmane
Primaarne süsinik on selline, mis on seotud ainult teise süsinikuga. Näiteks etaani molekul, CH3-CH3 koosneb kahest seotud primaarsest süsinikust. See näitab süsinikahela lõppu või algust.
Teisene
See on seotud kahe süsinikuga. Nii et propaani molekuli puhul CH3-CH2-CH3, söötme süsinikuaatom on sekundaarne (metüleenrühm, -CH2-).
Kolmanda taseme
Tertsiaarsed süsinikud erinevad ülejäänud poolest, sest nendest tulenevad peaahela harud. Näiteks 2-metüülbutaan (nimetatakse ka isopentaaniks), CH3-CH(CH3) -CH2-CH3 Sellel on tertsiaarne süsinik, mis on märgitud paksus kirjas.
Kvaternaar
Ja lõpuks, kvaternaarsed süsinikud, nagu nimigi ütleb, on seotud nelja teise süsinikuaatomiga. Neopentaani molekul, C(CH3)4 on kvaternaarne süsinikuaatom.
Kasutamine
Aatomimassi ühik
Keskmine aatomi mass 12C kasutatakse teiste elementide masside arvutamiseks standardmeetodina. Seega kaalub vesinik kahekümnendikku sellest süsinikuisotoopist, mida kasutatakse selleks, et määratleda, mida tuntakse aatomimassiühik u.
Seega saab teisi aatomi massi võrrelda 12C ja 1H. Näiteks magneesium (24Mg) kaalub umbes kaks korda rohkem kui süsinikuaatom ja 24 korda rohkem kui vesinikuaatom.
Süsinikutsükkel ja elu
Taimed absorbeerivad CO2 fotosünteesi protsessis, et vabastada hapnik atmosfääri ja toimida taimede kopsudena. Kui nad surevad, muutuvad nad söeks, mis pärast põletamist vabastab CO2. Üks osa naaseb taimedesse, kuid teine jõuab merepõhja, toites paljusid mikroorganisme.
Kui mikroorganismid surevad, jäävad tahked ained bioloogilisteks lagunemissaadusteks ja pärast miljoneid aastaid muunduvad see õli.
Kui inimkond kasutab seda õli alternatiivse energiaallikana kivisöe põletamisel, aitab see kaasa rohkem CO2 (ja muud soovimatud gaasid).
Teisest küljest kasutab elu süsinikuaatomeid kõige sügavamalt. See on tingitud tema võlakirjade stabiilsusest, mis võimaldab tal moodustada ahelaid ja molekulaarstruktuure, mis moodustavad makromolekulid sama olulised kui DNA.
NMR-spektroskoopia 13C
The 13C, kuigi see on palju väiksem kui 12C, selle arvukus on piisav molekulaarsete struktuuride selgitamiseks süsinik-13 tuuma magnetresonantsspektroskoopia abil.
Tänu sellele analüüsimeetodile saab määrata, millised aatomid ümbritsevad 13C ja millistele funktsionaalrühmadele nad kuuluvad. Seega saab määrata mis tahes orgaanilise ühendi süsiniku skeemi.
Viited
- Graham Solomons T.W., Craig B. Fryhle. Orgaaniline keemia. Amiinid (10. trükk.) Wiley Plus.
- Blake D. (4. mai 2018). Neli süsiniku karakteristikut. Välja otsitud andmebaasist: sciencing.com
- Royal Society of Chemistry. (2018). Süsinik. Vastu võetud: rsc.org
- Evolutsiooni mõistmine. (s.f.). Süsiniku aatom. Välja otsitud andmebaasist: evolution.berkeley.edu
- Encyclopædia Britannica. (14. märts 2018). Süsinik. Välja otsitud: britannica.com
- Pappas S. (29. september 2017). Faktid süsiniku kohta. Välja otsitud aadressilt: livescience.com


