Naatriumsulfiidi valemid, kasutusalad, ohud
The naatriumsulfiid (Na2S) on kristalliline tahke aine kollasest kuni telliskollaseni. Looduses leidub seda erinevates hüdratatsiooniastmetes, olles kõige tavalisem naatriumsulfiidi nonahüdraat (Na2S · 9H2O)..
Need on vees lahustuvad soolad, mis annavad tugevalt leeliselisi lahuseid. Niiske õhuga kokkupuutel neelavad nad õhust niiskust, mis võib iseenesest kuumeneda ja põhjustada lähedalasuvate põlevate materjalide süttimist. Samamoodi kiirgavad nad niiske õhuga kokkupuutel vesiniksulfiidi, mis lõhnab mädanenud munadega.

Need on tugevad redutseerijad. Need ained võivad olla keskkonnaohtlikud, eriti veeorganismidele.
Naatriummonosulfiid on kaubanduslikult saadaval helveste kujul, mis sisaldavad 60-62% Na2S ...
- Valemid

- CAS: 1313-82-2 naatriumsulfid (veevaba)
- CAS: 1313-84-4 naatriumsulfiid (nonahydrated)
2D struktuur
3D struktuur
Naatriumsulfiidi omadused
Füüsikalised ja keemilised omadused

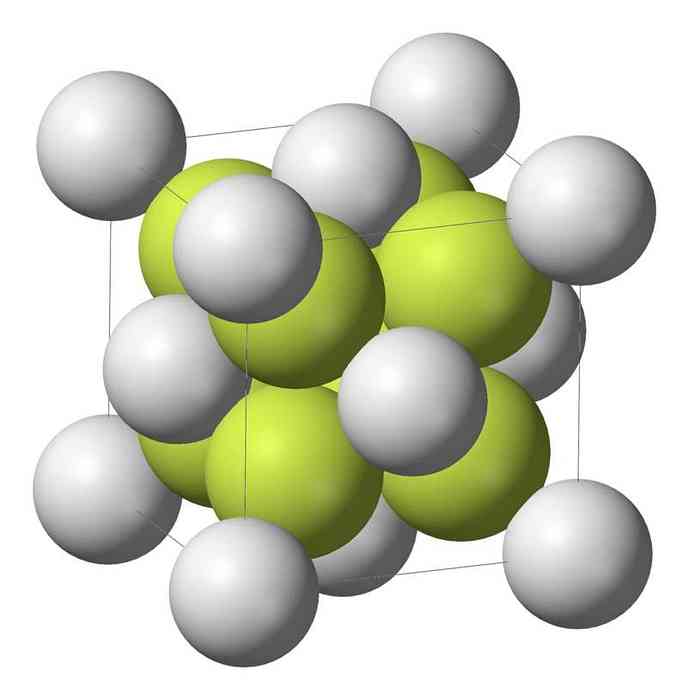
Naatriummonosulfiid (Na2S) kristalliseerub antifluoriidistruktuuriga, kus iga S aatomit ümbritseb 8 Na aatomite kuubik ja iga Na-aatom nelja aatomi tetraeedriga..
Süttivus
Ainus kergesti süttiv liige anorgaaniliste sulfiidide rühmas on vesiniksulfiid. Mõned teised anorgaanilised sulfidid, nagu naatriumsulfiid, võivad siiski iseenesest kuumeneda ja isegi süüdata niiskuse mõjul..
Tulekahju korral eraldab naatriumsulfid vääveldioksiidi gaase või aure, mis on ärritavad või toksilised.
Reaktsioonivõime
- Anorgaanilised sulfiidid on üldjuhul aluselised (mõned on tugevalt aluselised ja seetõttu ei sobi kokku hapetega).
- Paljud neist ühenditest on redutseerijad (nad reageerivad intensiivselt oksüdeerivate ainetega).
- Sulfiidide lihtsad soolad (nagu naatrium, kaalium ja ammooniumsulfid) reageerivad tugevalt hapetega, et vabastada väga toksilised ja tuleohtlikud vesiniksulfiidgaasid.
- Naatriumsulfiid on tuleohtlik. Kiiresti kuumutamisel või löögi korral plahvatab.
- Lagunemist kuumutades eraldab see naatriumoksiidi ja vääveloksiidide toksilisi aure.
- Reageerib ägedalt süsinikuga, söe, diasooniumsoolade, N, N-diklorometüülamiini, tugevate oksüdeerijate ja veega.
Toksilisus
Paljud anorgaaniliste sulfiidide rühma liikmed käituvad tugeva alusena ja võivad nahaga kokkupuutel põhjustada tõsiseid põletusi..
See omadus sõltub selle lahustuvusest. Kõige lahustumatud anorgaanilised sulfiidid (näiteks elavhõbeda (II) sulfiid ja kaadmiumsulfid) ei ole söövitavad.
Naatriumsulfiidil on oktanooli / vee jaotuskoefitsiendi (Pow) keskkond (-3,5). Seda väärtust kasutatakse aine lahustuvuse (ja biokontsentratsiooni) näitajana loomsetes rasvkoes (eriti veeloomades)..
Naatriumsulfiidi peetakse keskkonnale ohtlikuks, eriti veeorganismidele.
Kasutamine
Kodus kasutatakse naatriumsulfiidi torude, kodumajapidamises kasutatavate puhastusvahendite (ahju, vannitoa), juuste sirgendajate, nõudepesuvahendite ja auto-turvapatjade avamiseks..
Tööstuses kasutatakse seda puhastusvahendites, tsemendis ja muude keemiliste toodete valmistamisel.
Kliinilised toimed
Naatriumsulfiidi kokkupuude on arenenud riikides ja vähearenenud riikides nii tööstuses kui ka kodus. Need söövitavad ained on paljudes väikese kontsentratsiooniga majapidamistoodetes.
Arenenud riikides on tõsised tagajärjed haruldased. Need tekivad peamiselt kemikaali tahtliku allaneelamise tõttu täiskasvanutel. Kuid arengumaades on tõsised tagajärjed tavalisemad.
Leeliseline söövitav aine põhjustab vedeldamise tõttu nekroosi. Rasvade seebistamine rakumembraanis, raku hävitamine ja sügav tungimine limaskestade kudedesse.
Suukaudne kokkupuude
Esialgne põletik tekib seedetrakti koes, millele järgneb koe nekroos (võimaliku perforatsiooniga), seejärel granuleerimine ja lõpuks stenoosi moodustumine..
Kerge allaneelamisega patsientidel tekivad orofaründi, söögitoru või mao ärritus või I astme põletused (pindmine hüpereemia ja turse)..
Mõõduka intoksikatsiooniga patsiendid võivad tekkida II astme põletused (pindmised villid, erosioonid ja haavandid) koos võimaliku täiendava stenoosi (eriti söögitoru) tekkega..
Mõnedel patsientidel (eriti väikelastel) võib tekkida ülediste hingamisteede turse.
Raske intoksikatsiooniga patsientidel võivad tekkida seedetrakti limaskesta sügavad põletused ja nekroos, kus esineb komplikatsioone: perforatsioon (söögitoru, mao, harva kaksteistsõrmiksoole), fistuli moodustumine (tracheoesophageal, aortoesophageal) ja seedetrakti verejooks.
Nad võivad areneda: hüpotensioon, tahhükardia, tahhüpnoe, kitsenduse teke (peamiselt söögitoru), söögitoru kartsinoom ja ülemiste hingamisteede turse (mis on üldine ja sageli eluohtlik).
Raske mürgistus piirdub tavaliselt täiskasvanute tahtliku tarbimisega.
Kokkupuude sissehingamise teel
Kerge kokkupuude võib põhjustada köha ja bronhospasmi.
Raske sissehingamine võib põhjustada ülemiste hingamisteede turset, põletusi, stridori ja harva ägedat kopsukahjustust..
Silma sattumine
See võib põhjustada tugevat sidekoe ärritust ja kemoosi, sarvkesta epiteeli defekte, limbilist isheemiat, püsivat nägemiskaotust ja rasketel perforatsioonijuhtudel..
Naha kokkupuude nahaga
Kerge kokkupuude põhjustab ärritust ja osalise paksuse põletusi. Raske põletuse või šokiga patsientidel võib tekkida metaboolne atsidoos.
Pikaajaline kokkupuude või kõrge kontsentratsiooniga tooted võivad põhjustada kogu paksuse põletusi.
Turvalisus ja riskid
Kemikaalide klassifitseerimise ja märgistamise ülemaailmselt harmoneeritud süsteemi ohuaruanne (SGA)
Kemikaalide klassifitseerimise ja märgistamise ülemaailmne harmoneeritud süsteem (SGA) on rahvusvaheliselt kokkulepitud süsteem, mille on loonud Ühinenud Rahvaste Organisatsioon ja mille eesmärk on asendada eri riikides kasutatavad erinevad klassifitseerimis- ja märgistamisstandardid, kasutades ühtseid kriteeriume kogu maailmas..
Ohuklassid (ja nende vastavad GHSi peatükid), klassifitseerimise ja märgistamise standardid ning soovitused naatriumsulfiidi kohta on järgmised (Euroopa Kemikaaliamet, 2017, ÜRO, 2015, PubChem, 2017):







Viited
- Benjah-bmm27, (2006). Fluoriit-ühik-raku-3D-iooniline [image] Välja otsitud andmebaasist: wikipedia.org.
- ChemIDplus, (2017). 1313-82-2 [image] Välja otsitud andmebaasist: chem.nlm.nih.gov.
- ChemIDplus, (2017). 3D-struktuur 1313-82-2 - naatriumsulfiid [image] Välja otsitud andmebaasist: chem.nlm.nih.gov.
- ChemIDplus, (2017). 3D-struktuur 1313-84-4 - naatriumsulfiid [image] Välja otsitud andmebaasist: chem.nlm.nih.gov.
- Euroopa Kemikaaliamet (ECHA). (2017). Klassifitseerimise ja märgistamise kokkuvõte.
- Ühtlustatud klassifikatsioon - määruse (EÜ) nr 1272/2008 VI lisa (CLP-määrus). Naatriumsulfid. Välja otsitud 16. jaanuaril 2017 aadressil: echa.europa.eu.
- Euroopa Kemikaaliamet (ECHA). (2017). Klassifitseerimise ja märgistamise kokkuvõte.
- Teavitatud klassifikatsioon ja märgistamine. Naatriumsulfid, hüdraatunud. Välja otsitud 16. jaanuaril 2017 aadressil: echa.europa.eu.
- Ohtlike ainete andmepank (HSDB). TOXNET (2017). Naatriumsulfid. Bethesda, MD, EL: Riiklik meditsiiniraamatukogu. Välja otsitud: toxnet.nlm.nih.gov.
- Lange, L., ja Triebel, W. (2000). Sulfiidid, polüsulfiidid ja sulfaanid. Ullmanni tööstuskeemia entsüklopeedias. Wiley-VCH Verlag GmbH & Co. KGaA. Välja otsitud aadressilt dx.doi.org.
- ÜRO (2015). Keemiliste toodete klassifitseerimise ja märgistamise ülemaailmne harmoneeritud süsteem (SGA) Kuues parandatud versioon. New York, Ameerika Ühendriigid: ÜRO väljaanne. Välja otsitud andmebaasist: unece.org.
- Riiklik biotehnoloogia teabekeskus. PubChem Compound andmebaas. (2016). Naatriumsulfiidi enneahüdraat - PubChem struktuur [image] Välja otsitud andmebaasist: pubchem.ncbi.nlm.nih.gov.
- Riiklik biotehnoloogia teabekeskus. PubChem Compound andmebaas. (2017). Naatriummonosulfiid. Bethesda, MD, EL: Riiklik meditsiiniraamatukogu. Välja otsitud andmebaasist: pubchem.ncbi.nlm.nih.gov.
- Riiklik biotehnoloogia teabekeskus. PubChem Compound andmebaas. (2017). Naatriumsulfidi enneahüdraat. Bethesda, MD, EL: Riiklik meditsiiniraamatukogu. Välja otsitud andmebaasist: pubchem.ncbi.nlm.nih.gov.
- Riiklik ookeani- ja atmosfäärijuhtimine (NOAA). CAMEO kemikaalid. (2017). Keemiline andmeleht. Veevaba naatriumsulfid. Silver Spring, MD. EL; Välja otsitud andmebaasist: cameochemicals.noaa.gov.
- Riiklik ookeani- ja atmosfäärijuhtimine (NOAA). CAMEO kemikaalid. (2017). Reageeriva grupi andmeleht. Sulfiidid, anorgaanilised. Silver Spring, MD. EL; Välja otsitud andmebaasist: cameochemicals.noaa.gov.
- Ondřej Mangl, (2007). Sulfid sodný - Na2S [image] Välja otsitud andmebaasist: wikipedia.org.
- PubChem, (2016). Naatriummonosulfiid [image] Välja otsitud andmebaasist: puchem.nlm.nih.gov.
- PubChem, (2016). Naatriumsulfiid enneahüdraat [image] Välja otsitud andmebaasist: puchem.nlm.nih.gov.
- Wikipedia. (2017). Oktanool-vesi jaotuskoefitsient. Välja otsitud 17. jaanuaril 2017: wikipedia.org.
- Wikipedia. (2017). Naatriumsulfid. Välja otsitud 17. jaanuaril 2017: wikipedia.org.


