Naatriumsulfaadi valem, omadused, struktuur, rakendused
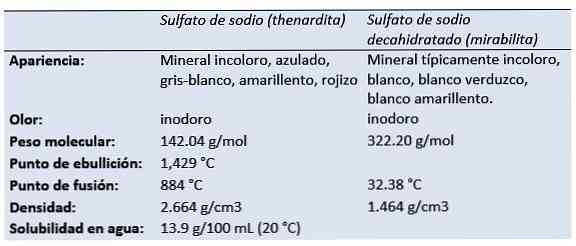
The naatriumsulfaat (väävelhappe dinaatriumsool, dinaatriumtetraoksidosulfaat, sooda sulfaat, Glauberi sool, siisardiit, mirabiliit) on anorgaaniline ühend valemiga Na2SO4 ja sellega seotud hüdraadid. Kõik vormid on valged tahked ained, mis on vees väga hästi lahustuvad.
Seda peetakse üheks peamiseks turustatavaks keemiatootele. Selle ülemaailmne tootmine (peaaegu eranditult dekahüdraadina) ulatub umbes 6 miljoni tonnini aastas.

Siin on veevaba naatriumsulfaadi mineraal, mida toodetakse kuivades aurustunud keskkondades kuivades koobastes, vanades kaevandamistoimingutes kui lillekivid ja fumaroolide ümbrusena..
Esmakordselt kirjeldati seda 1825. aastal Salinas Espartinas (Ciempozuelos, Madrid, Hispaania) ja sai nimeks tadardita prantsuse keemiku Louis Jacques Thénardi (1777-1826) auks.

Hollandi / saksa keemik ja apteeker Johann Rudolf Glauber (1604-1670) avastas 1625. aastal Austria kevadel, naatriumsulfaadi dekahüdraadil (hiljem tuntud kui Glauberi sool). Ta nimetas seda mirabilisoolaks (ime soolaks) tänu oma meditsiinilistele omadustele.
Aastatel 1650–1660 hakkas Glauber tootma naatriumsulfaati tavalisest soolast (NaCl) ja kontsentreeritud väävelhappest. Seda protsessi peetakse keemiatööstuse alguseks.
Selle kristalle kasutati lahtistina kuni 20. sajandini.
Kaheksateistkümnendal sajandil hakati Glauberi soola ja kaaliumkarbonaadi reaktsiooni kasutama naatriumkarbonaadi (naatriumkarbonaadi) tööstuslikuks tootmiseks..

Praegu kasutatakse seda peamiselt detergentide valmistamiseks ja Kraftprotsessis paberimassi tootmiseks (domineeriv meetod paberi valmistamisel)..
Naatriumsulfaadi maardlaid leidub Ameerika Ühendriikides, Kanadas, Hispaanias, Itaalias, Türgis, Rumeenias, Mehhikos, Botswanas, Hiinas, Egiptuses, Mongoolias ja Lõuna-Aafrikas.
Peamised tootjad on Hiina (Jiangsu ja Sichuani provintsid), millele järgneb Hispaania, kus asub maailma suurim glauberiitide ladestus (Cerezo de Río Tirón, Burgos).
Loodusliku naatriumsulfaadi kogutoodang maailmas on hinnanguliselt umbes 8 miljonit tonni ja see on muude tööstusprotsesside kõrvalsaadusena 2–4 miljonit tonni..
Hispaanias, vastavalt naatriumsulfaadi loodusvarade riiklikus inventuuris avaldatud teabele ja muudele ajakohastatud andmetele, on naatriumsulfaadi mineraalide hinnangulised varud suurusjärgus 730 miljonit tonni, mis on kataloogitud "reservidena" ja 300 miljonit tonni rohkem kui "muud ressursid"..
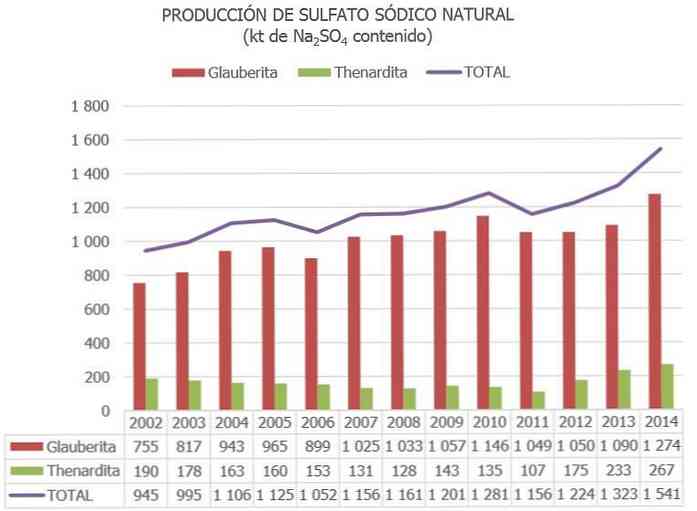
Praegu on Euroopa Liidus ainus riik, kus on naatriumsulfaadi maagid (peamiselt siitardit, glauberiiti ja Mirabiliiti)..
Praegu on tekstiilitööstuses üldiselt vähenenud naatriumsulfaadi nõudlus.
Viimastel aastatel on muudes sektorites, näiteks pesuvahendites, mõnes piirkonnas mõnevõrra kasvanud, kuna nende tooraine hind on madal.
Naatriumsulfaadi detergentide peamised laienevad turud on Aasias, Kesk-Ameerikas ja Lõuna-Ameerikas.
Valemid

2D struktuur
3D struktuur
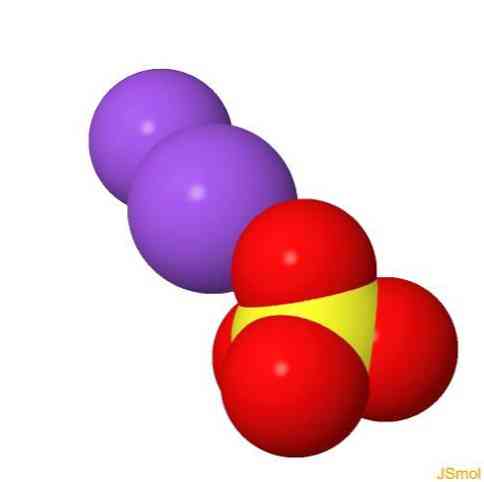
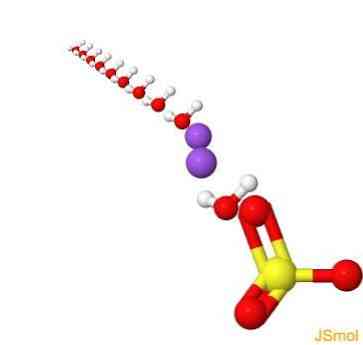
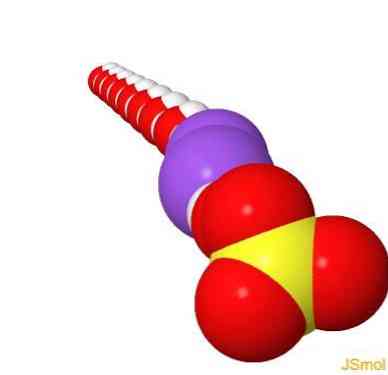
Omadused
Füüsikalised ja keemilised omadused
Naatriumsulfaat kuulub naatriumühendite reaktiivsesse rühma ja kuulub ka sulfaatide, vesiniksulfaatide ja disulfiidide rühma..
Süttivus
See on mittesüttiv aine. Selle pulbri plahvatusoht puudub.
Reaktsioonivõime
Naatriumsulfaat on vees väga hästi lahustuv ja hügroskoopne. See on väga stabiilne, olles normaalsel temperatuuril enamiku oksüdeerivate või redutseerivate ainete suhtes mitte-reaktiivne. Kõrgetel temperatuuridel võib selle muundada naatriumsulfiidiks karbotermilise redutseerimise teel.
Keemiliselt mitteaktiivseid aineid peetakse tüüpilistes keskkonnatingimustes mitteaktiivseteks (kuigi nad võivad reageerida suhteliselt äärmuslikes tingimustes või katalüüsis). Nad on oksüdatsiooni ja redutseerimise suhtes vastupidavad (välja arvatud äärmuslikes tingimustes).
Ohtlikud keemilised reaktsioonid
Alumiiniumi sulatamisel koos naatrium- või kaaliumsulfaadiga tekib vägivaldne plahvatus.
Toksilisus
Keemiliselt mitteaktiivseid aineid peetakse mittetoksilisteks (kuigi selle rühma gaasilised ained võivad toimida asfiksiina).
Kuigi naatriumsulfaati peetakse üldiselt mittetoksiliseks, tuleb seda käsitseda ettevaatlikult. Pulber võib põhjustada astmat või ajutist ärritust. Seda riski saab vältida silmade kaitsmise ja paberimaski kandmise teel.
Kasutamine
Selle peamised rakendused on:
- pesuvahendi pulber.
- paberimass.
- tekstiil.
- klaas.
- ensüümide süntees (veinivalmistamine).
- inimeste ja loomade toit.
- farmaatsiatooted.
- põhikemia üldiselt.
- terase protsessid.
- Detergendi pulber
Naatriumsulfaat on väga odav materjal. Selle suurim kasutusviis on täiteainena leibkonna pulbrilistes detergentides, mis tarbivad u. 50% maailma toodangust. Uued kompaktsed või vedelad detergendid ei sisalda naatriumsulfaati, mistõttu see kasutamine väheneb.
Veel üks tähtsuselt vähenev naatriumsulfaadi kasutamine, eriti USAs. ja Kanadas, on puidumassi valmistamiseks Krafti protsessis. Protsessi termilise efektiivsuse edusammud vähendasid drastiliselt naatriumsulfaadi vajadust.
Klaasitööstus annab veel ühe olulise rakenduse naatriumsulfaadile. See on suuruselt teine rakendus Euroopas. Naatriumsulfaati kasutatakse sulatatud klaasist väikeste õhumullide kõrvaldamiseks.
Jaapanis on suurim naatriumsulfaadi kasutamine tekstiiltoodete valmistamisel. Naatriumsulfaat aitab värvidel tungida kiududesse ühtlaselt ja ei korrodeeri värvimisel kasutatavaid roostevabast terasest anumaid (erinevalt naatriumkloriidist, mis on alternatiivne meetod).
Naatriumsulfaat sobib eriti madala kvaliteediga päikeseenergia (hilisemaks vabastamiseks kütteseadmetes) ladustamiseks, kuna selle faasimuutuse ajal tahkest vedelikust on suur temperatuur, mis on antud temperatuuril 32 ° C..
Jahutamiseks kasutatakse segu naatriumkloriidi (NaCl) soolaga, mis vähendab sulamistemperatuuri 18 ° C-ni.
Laboris kasutatakse veevaba naatriumsulfaati laialdaselt inertse kuivatusainena, et eemaldada orgaaniliste lahuste vee jälgi. Selle toime on aeglasem kui magneesiumsulfaadil, kuid seda võib kasutada mitmesuguste materjalidega, kuna see on keemiliselt üsna inertne.
Naatriumsulfaadi dekahüdraati (Glauberi soola) kasutati ajalooliselt lahtistina. See on efektiivne teatud ravimite nagu atsetaminofeen (atsetaminofeen) elimineerimiseks organismist pärast üleannustamist..
Teised naatriumsulfaadi rakendused hõlmavad selle kasutamist lisaainena vaipade õhuvärskendajate valmistamisel, söödalisandina ja tärklise valmistamisel..
Kliinilised toimed
Terapeutiliste rakenduste jaoks kuulub naatriumsulfaat soolalahuse ja kõhukinnisuse raviks kasutatavate katartiliste lahtistite kategooriasse..
Soolalähedased katartikumid on soolad, mis säilitavad sooles vedelikke mitteimendunud soola osmootse toimega, põhjustades kaudselt peristaltika suurenemist.
Soolakateemikad imenduvad seedetraktis halvasti, mistõttu süsteemne toksilisus on ebatõenäoline, välja arvatud juhul, kui suurtes kogustes on alla neelatud. Kuid suured ekspositsioonid võivad põhjustada dehüdratsiooni ja elektrolüütide muutusi, mis on sekundaarsed ühendi osmootse toimega.
Krooniline kõhulahtisus võib esineda söömishäiretega, Munchauseni sündroomi või faktiliste häiretega patsientidel. Üldiselt esineb patsientidel iiveldus, oksendamine ja kõhulahtisus, mis on seotud kõhukrambidega. Tõsised toimed võivad hõlmata dehüdratsiooni, hüpotensiooni, hüpernatreemiat ja elektrolüütide kõrvalekaldeid.
Turvalisus ja riskid
Kemikaalide klassifitseerimise ja märgistamise ülemaailmselt harmoneeritud süsteemi ohuaruanne (SGA).
Kemikaalide klassifitseerimise ja märgistamise ülemaailmne harmoneeritud süsteem (SGA) on rahvusvaheliselt kokkulepitud süsteem, mille on loonud Ühinenud Rahvaste Organisatsioon ja mille eesmärk on asendada eri riikides kasutatavad erinevad klassifitseerimis- ja märgistamisstandardid ühtsete ülemaailmsete kriteeriumide abil (ÜRO United, 2015).
Ohuklassid (ja nende vastav peatükk GHSis), klassifitseerimis- ja märgistamisstandardid ning soovitused naatriumsulfaadi kohta on järgmised (Euroopa Kemikaaliamet, 2017, ÜRO, 2015, PubChem, 2017):
GHSi ohuklassid
H315: Põhjustab nahaärritust [Hoiatus Nahka söövitav / ärritav - 2. kategooria].
H317: Võib põhjustada allergilist nahareaktsiooni [Hoiatustundlikkus, nahk - 1. kategooria].
H319: Põhjustab tugevat silmade ärritust [Hoiatus Tõsine silmakahjustus / silmade ärritus - 2.A kategooria].
H412: Kahjulik veeorganismidele, millel on pikaajalised kahjulikud mõjud [Ohtlik veekeskkonnale, pikaajaline oht - 3. kategooria].
(PubChem, 2017)
Usaldatavusnõukogude koodid
P261, P264, P272, P273, P280, P302 + P352, P305 + P351 + P338, P321, P332 + P313, P333 + P313, P337 + P313, P362, P363 ja P501.
Viited
- ChemIDplus (2017) 3D-struktuur 7757-82-6 - veevaba naatriumsulfaat [image]. Välja otsitud: chem.nlm.nih.gov.
- ChemIDplus (2017) 3D-struktuur 7727-73-3 - naatriumsulfaat [USP] [image]. Välja otsitud: chem.nlm.nih.gov.
- Dyet, D. (2007) Thenardite naatriumsulfaat, Sodaville Mineral County Nevada lähedal [image] Välja otsitud andmebaasist: en.wikipedia.org.
- Euroopa Kemikaaliamet (ECHA), (2017). Klassifitseerimise ja märgistamise kokkuvõte. Ühtlustatud klassifikatsioon - määruse (EÜ) nr 1272/2008 VI lisa (CLP-määrus). Naatriumsulfaat.
- Grumetisho (2012) Mirabilita [image] Välja otsitud andmebaasist: es.wikipedia.org.
- Ohtlike ainete andmepank (HSDB). TOXNET (2017). Naatriumsulfaat Bethesda, MD, EL: Riiklik meditsiiniraamatukogu. Välja otsitud: toxnet.nlm.nih.gov.
- Hispaania Geoloogilise ja Kaevandamise Instituut (IGME) (2016). GLAUBERITA-THENARDITA (NATURAL SODIUM SULPHATE) 2014. Kaevandamise panoraam. Välja otsitud andmebaasist: igme.es.
- Riiklik tööohutuse instituut (INSHT). (2010). Rahvusvahelised ohutuskaardid. Naatriumsulfaat. Töö- ja julgeolekuministeerium. Madrid ES Välja otsitud andmebaasist: insht.es.
- Langbein Rise (2008) Pidev kraftmassi mil [image] Välja otsitud andmebaasist: wikimedia.org.
- ÜRO (2015). Keemiliste toodete klassifitseerimise ja märgistamise ülemaailmne harmoneeritud süsteem (SGA) Kuues parandatud versioon. New York, Ameerika Ühendriigid: ÜRO väljaanne. Välja otsitud andmebaasist: unece.org.
- Riiklik biotehnoloogia teabekeskus. PubChem Compound Database (2016) naatriumsulfaat - PubChem struktuur [image] Bethesda, MD, EL: Riiklik meditsiiniraamatukogu. Välja otsitud andmebaasist: pubchem.ncbi.nlm.nih.gov.
- Riiklik biotehnoloogia teabekeskus. PubChem Compound Database (2016) naatriumsulfaat - PubChem struktuur [image] Bethesda, MD, EL: Riiklik meditsiiniraamatukogu.
- Riiklik biotehnoloogia teabekeskus. PubChem Compound andmebaas. (2017). Dekahüdreeritud naatriumsulfaat. Bethesda, MD, EL: Riiklik meditsiiniraamatukogu. Välja otsitud andmebaasist: pubchem.ncbi.nlm.nih.gov.
- Riiklik biotehnoloogia teabekeskus. PubChem Compound andmebaas. (2017). Naatriumsulfaat Bethesda, MD, EL: Riiklik meditsiiniraamatukogu. Välja otsitud andmebaasist: pubchem.ncbi.nlm.nih.gov.
- Walkerma (2005) Naatriumsulfaat [image] Välja otsitud andmebaasist: wikimedia.org.
- Wikipedia (2017) Kraftprotsess. Välja otsitud andmebaasist: wikipedia.org.
- Wikipedia (2017) Mirabilita. Välja otsitud andmebaasist: wikipedia.org.
- Wikipedia (2017) Mirabilite. Välja otsitud andmebaasist: wikipedia.org.
- Wikipedia (2017) Naatriumsulfaat. Välja otsitud andmebaasist: wikipedia.org.
- Wikipedia (2017) Solfato di nátrium decaidrate. Välja otsitud aadressilt: https://it.wikipedia.org.
- Wikipedia (2017) Naatriumsulfaat. Välja otsitud andmebaasist: wikipedia.org.
- Wikipedia (2017) Thenardita. Välja otsitud andmebaasist: wikipedia.org.
- Wikipedia (2017) Thenardite. Välja otsitud: .wikipedia.org.


