Lahustuvad omadused, erinevused lahustiga ja lahustiga, näited
The lahustunud, lahendus,see on aine, mis lahustub lahustis. Üldiselt leitakse lahustunud aine vähemal määral ja see võib olla tahke, vedel või gaasiline. Vastupidi, lahusti on suuremas koguses lahuse komponent.
Näiteks soolases vees on sool lahustunud ja lahusti on vesi. Siiski ei ole kõik lahustunud ained tahked või lahustid on vedelad.

Selles mõttes on mitmeid võimalikke lahustite ja lahustite kombinatsioone: gaas vedelikus, tahke aine, vedel vedelik, tahke aine vedelik või tahke aine tahkes;.
Et tuvastada, milline on lahuses lahust, tuleb arvesse võtta kahte aspekti. Esiteks, lahustunud aine on aine, mis on väiksem. Lisaks sellele muudab see füüsikalist olekut (tahke, vedel või gaasiline) lahusesse integreerimisel.
Indeks
- 1 Lahused, lahustid ja lahustunud ained
- 2 Lahustunud aine määratlus
- 3 Omadused
- 3.1 Lahustuvus
- 3.2 Temperatuur
- 3.3 Lahuse küllastumine
- 3.4 Rõhk
- 3.5 Polaarsus
- 4 Erinevused lahustunud aine ja lahusti vahel
- 5 Lahustunud näited
- 5.1 Solutos gaasilises olekus
- 5.2 Solutos tahkes olekus
- 5.3. Solutos vedelas olekus
- 5.4 Solutos, mida saab kasutada kodus
- 6 Viited
Lahused, lahustid ja lahustunud ained
Keemias on homogeensed segud, milleks on nende koostisosade võrdsed osad. Üks kõige tavalisemaid homogeensete segude tüüpe on lahused, mis on kahe või enama aine stabiilsed homogeensed segud, kui lahustunud aine lahustub lahustis..
Lahuseid, lahusteid ja lahustuvaid aineid täheldatakse igapäevases olukorras ja vahemikus, mis varieerub tööstuslikult laboris. Need segudest moodustunud ained on uuritavate objektide tõttu nende omaduste ja nende vahel esinevate jõudude ja / või vaatamisväärsuste tõttu..
Lahjendatud aine määratlus
Nagu eespool märgitud, on lahustunud aine see aine, mis lahustub teise, mida nimetatakse lahustiks.
Tavaliselt on lahustunud aine osakaal väiksem ja võib esineda mis tahes kolmes olekus. Kui lahendus on esitatud kahe aine vahel, mis on samas faasis, kasutatakse meetodit, mille abil valida, milline on lahustunud aine ja mis on lahusti..
Lahustuvust reguleerib lahustunud aine lahustuvus. Lahusti temperatuur on samuti määravaks teguriks, kui on vaja teada, kas lahus on moodustatud või mitte, kuna mida kõrgem on lahusti temperatuur, seda suurem on lahustunud aine kogus, mis võib selles lahustuda..
On aineid, mida nimetatakse pindaktiivseteks aineteks, mis muutuvad kõrgematel temperatuuridel vähem lahustuvateks, kuid need on erandid ja täidavad teatud ülesandeid.
Protsess, milles lahusti interakteerub lahusega moodustunud soluudiga, on määratletud kui solvaatumine ja see hõlmab sidemete ja vesiniku sildade moodustumist lisaks van der Waalsi jõudude vaatamisväärsustele..
Omadused
Lahustid moodustavad erinevates riikides tohutu hulga erinevaid keemilisi aineid, neil on erinevad lahustumismahud ja neil on palju omadusi, mis mängivad olulist rolli homogeensete segude moodustamisel. Mõned soluutide põhiomadused on järgmised:
Lahustuvus
Lahustuvus on ühendi võime lahustuda teises aines. See võime on tihedalt seotud segunemisvõimega, milleks on vedeliku võime seguneda konkreetse ainega; Kui te ei saa liituda, on see segadus.
Segatavuse vahemik on rohkem kui konkreetne number, mistõttu võib öelda, et üks aine on täielikult, osaliselt või mitte segunev teises.
Lahustuv lahustuv omadus sõltub omakorda teistest teguritest, mis võivad seda mahtu suurendada või vähendada, kuna need mõjutavad lahustuvate ainete ja lahustite vahelise intermolekulaarsete jõudude tasakaalu..
Veel vähem oodatavaid funktsioone, nagu soluudi tilga suurus või kristallstruktuuri struktuur, võivad mõjutada nende võimet lahustuda.
Temperatuur
Süsteemi temperatuur, kus lahustub lahustunud aine, võib mõjutada selle lahustuvust: enamiku tahkete ainete ja vedelike puhul suurendavad need lahustuvust vastavalt temperatuuri tõusule..
Seevastu gaasides täheldatakse keerulist käitumist, mida näidatakse madalamas lahustuvuses vees kõrgematel temperatuuridel, kuid suurem orgaanilistes lahustites..
Lahuse küllastumine
Seda nimetatakse lahuse küllastamiseks sellisel määral, mil lahus on lahustanud lahustunud aine, mida nimetatakse küllastatud lahuseks nii palju, kui see on lahustunud nii palju kui võimalik. Sellest hetkest alates sadestub lisatud lahustunud aine liigse mahuna kasutatud mahuti põhjas; enne seda nimetatakse lahust küllastumata.
Küllastamispunkti on võimalik läbida ja lahustunud lahustuda, kuid see nõuab temperatuuri tõusu. Lahust, mis sisaldab liigset lahustunud ainet ja mida on kuumutatud, nimetatakse üleküllastunud lahuseks.
Rõhk
Rõhumuutused ei mõjuta tavaliselt tahkete ainete ja vedelike lahustuvust, välja arvatud mõningatel erandjuhtudel (kaltsiumsulfaadi akumuleerumine naftatorudes), kuid gaasides on see määrav tegur nende lahustumisvõime suhtes..
Tegelikult on gaasi lahustuvus lahustis otseselt proportsionaalne selle gaasi osalise rõhuga nimetatud lahustis.
Polaarsus
Lahustuvuse mõõtmisel on soluudi polaarsus otsustava tähtsusega; lahustunud aine lahustub paremini lahustis, millel on sarnane keemiline struktuur.
Näiteks on väga polaarsetel või hüdrofiilsetel ainetel suurem lahustuvus väga polaarsetes lahustites, samas kui nad ei ole mittepolaarsetes ainetes praktiliselt lahustuvad..
Samamoodi mängivad molekulidevahelised jõud olulist rolli solvaatimises ja lahusti lahustumise lihtsus: suurem dipool-dipooljõud, vesiniksidemed ja muud sidemed, seda suurem on lahusti võime lahustuda lahustunud ja moodustavad lahuse.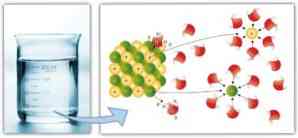
Lahuse ja lahusti vahelised erinevused
- Lahustunud aine on aine, mis lahustub; lahusti on lahusti (te) lahustamise vahend..
- Lahustatud aine võib olla tahkes, vedelas või gaasilises faasis; lahusti on tavaliselt vedelas faasis, kuid see on olemas ka tahkes ja gaasilises.
- Lahustuv lahustuvus sõltub rohkem sellistest omadustest nagu pind; Solvaadi võimsus sõltub muu hulgas ka polaarsusest, temperatuurist ja rõhust.
- Lahustunud aine on tavaliselt tööstuslikes protsessides ekstraheeritav soovitud komponent; Lahusti ei ole tavaliselt soovitud komponent ja see kõrvaldatakse tööstusprotsessides.
Lahustunud ainete näited
- Suhkur on tahke faasi lahustunud näide, mida tavaliselt kasutatakse vee magustamiseks.
- Heksaani võib leida parafiinvahast, mis toimib vedelate lahustitena, mis muudab selle tahke kuju.
- Süsinikdioksiid on jookidele lisatav gaas, mis annab neile kihisemise.
Solutos gaasilises olekus
Süsinikdioksiid vees (karastusjoogid)
Süsivesinik on süsinikdioksiidi sisaldav vesi, mis tekib süsinikdioksiidi rõhu all vee kaudu.
Gaseeritud mineraalvesi esineb looduslikult pikka aega. Need kihisevad veed on tingitud liigsest süsinikdioksiidist veekihis, mis on lahustunud rõhu all.
Üks tuntumaid näiteid soluutidest on kaubanduslikud karastusjoogid, mis on kombineeritud siirupiga.
Süsinikdioksiidi olemasolu muudab need veed ja karastusjookid isuäratavamaks ja visuaalselt atraktiivsemaks.
Hapnik ja muud gaasid lämmastikus (õhk)
Õhk atmosfääris koosneb erinevate gaaside molekulidest. See koosneb põhiliselt 78% lämmastikust ja umbes 21% hapnikust (lahustunud). Lisaks sisaldab see peaaegu 1% argooni ja teisi molekule, kuid väga väikestes kogustes.
Propaan butaanis (keetmisgaas)
Seda kombinatsiooni, mida tuntakse ka veeldatud naftagaasina, hakati kasutama alates 1860. aastast kodumajapidamises kasutatava kütuse allikana..
Sellest ajast alates on ta oma tootmist ja tarbimist laiendanud nii kodu- kui ka tööstuslikuks kasutamiseks. Kuna mõlemad gaasid on väga lõhnatud ja ohtlikud, lisatakse aine, mida nimetatakse merkaptaaniks, mis teeb võimalikuks lekke..
Solutos tahkes olekus
Vasktsink (messing)
Messingina tuntud kaubanduslik sulam koosneb tsingist (5 kuni 40%), mis on lahustatud vases. Tsink aitab tõmbetugevust suurendada. Sellele sulamile võib lisada teisi elemente, nagu tina, raud, alumiinium, nikkel ja räni.
Jood alkoholis (joodi tinktuur)
Veel üks näide populaarselt tuntud lahustitest on joodi tinktuur. See lahus sisaldab etüülalkoholi joodi (44 kuni 50%). Joodi tinktuuri kasutatakse antiseptikuna.
Sool vees (merevesi)
Merevesi katab rohkem kui 70% Maa pinnast. See on 96,5% vee, 2,5% soolade ja teiste ainete väiksema koguse segu. See hõlmab anorgaanilisi ja lahustunud orgaanilisi materjale, osakesi ja mõnda atmosfääri gaasi.
Solutos vedelas olekus
Alkohol vees (alkohoolsed joogid)
Suhkru kääritamisel saadud etanool või etüülalkohol (lahustunud) segatakse alkoholiga jookide valmistamiseks kindla proportsiooniga veega.
See ühend on organismis kergesti seeditav, kuid selle tarbimine liigselt võib põhjustada tõsist tervisekahjustust.
Vesi õhus (õhuniiskus)
Vesi õhus on üldtuntud kui udu. Selle põhjuseks on väikesed vee tilgad, mis on õhku suspendeeritud ja mis on põhiliselt tingitud maa jahutamisest öösel.
Sel viisil põhjustab see jahutus ümbritseva õhu temperatuuri alandamise. Seejärel ilmneb see nähtus, kui selles säilib kondenseerunud vesi.
Äädikhape vees (äädikas)
Äädikas on terav maitse, mida kasutatakse maitse lisamiseks või toidu säilitamiseks. See valmistatakse veega segatud äädikhappe lahusega.
Äädikhappe kontsentratsioon on varieeruv. Näiteks destilleeritud äädika osakaal on 5–8%.
Elavhõbe hõbedas (amalgaamid või hambapakendid)
Hammastäidiste jaoks kasutatavad amalgaamid moodustavad 2% elavhõbedast koos sulamiga, mis toimib lahustina. See sulam sisaldab 70% hõbedat. Võite lisada ka tina, vase ja tsingi.
Solutos, mida saab kasutada kodus
Suhkur vees
Suhkur on molekulaarne ja polaarne ühend ning sellel on võime lahustuda vees, mis on samuti polaarne element.
Suhkru struktureerimise viis põhjustab lahustumisprotsessi muutumise. Näiteks, kui suhkur on tükkideks, kulub lahustumiseks rohkem aega kui terades.
Mõned eksperdid usuvad, et vesi suhkruga on kehale väga oluline energiaallikas. On olemas isegi uuringuid, mis näitavad selle lahenduse tõhusust inimestel, kes teevad füüsilist tegevust.
Suhkur pulbris
Koogi valmistamisel on tavaline, et tahkeid koostisosi segatakse esmalt, seejärel lisage vedelikud.
Suhkur on lahus, mis on kinnitatud jahu külge, tekitades kooki põhisegu. Lisaks nendele kahele koostisosale lisatakse teised hiljem, nagu munad, või või vanilje.
Seda tüüpi lahustunud aine on tahke ja sel juhul segatakse see ka tahke ainega. Saadud alust võib kasutada ka magusa leiva, küpsiste, kookide, käsnakoogide, väikeste pudingite ja paljude teiste magusate toiduainete valmistamiseks..
Mahla pulber vees
On olemas suur hulk pulbristatud mahla, mis valmistatakse selle elemendi vees lahustamisel. Sel juhul on lahustunud aine mahla pulber ja lahusti on vesi.
Lahusti kogus peab olema suurem kui lahustunud aine kogus, seega tavaliselt klaasi vees lahustatakse üks või kaks supilusikatäit mahla pulbrit. Isegi on mõned pulbrid, mille kontsentratsioon on suurem ja väiksem.
Nende mahlade suhtes on tekitajaid, kuna need näitavad, et nende koostisosad (näiteks säilitusained, stabilisaatorid ja magusained) on tervisele kahjulikud.
Kloor vees
Üks viis vee puhastamiseks on vees lahustunud kloori kasutamine vees. Seda desinfektsioonivahendit iseloomustab see, et see on üks kõige sagedamini kasutatavaid mikroobide kõrvaldamiseks, ja on ideaalne, et mitteveetav vesi jõuaks kiireks, majanduslikuks ja lihtsaks..
Selle lahuse lahustunud kloor tuleks lisada vette kontsentratsioonis, mis ei ületa 0,2 ja 0,5 milligrammi liitri kohta..
Kasutatava kloori kogus peaks olema väga väike, sest see aine võib olla väga mürgine, kui seda tarbitakse või paljudes kogustes kokku puututakse.
See vee puhastamise meetod on tuntud kui kloorimine ja seda võib rakendada mäe ekskursiooni keskel või kodus, et kõrvaldada bakterid ja mikroobid, mida võib leida torudes, mille kaudu vesi läbib..
Värvimine vees
Vesi on kõige universaalsem lahusti, mis on olemas, ja see on ka alus, mille alusel lahustub tahke aine, näiteks värv.
Värv lahustub tavaliselt erinevatel põhjustel. Kõige tavalisem on harjade ja muude värvimiseks kasutatavate tööriistade puhastamise hõlbustamine.
Maalid on palju; Need, mis vees kõige paremini lahustuvad, on lateks. Lisaks tööriistade parema puhastamise võimaldamisele on värvi vees lahjendamise eelis enne värvimise alustamist see, et see tagab värvitud pinnale parema viimistluse..
Piimapulber vees
Piimapulber on lahustunud aine, mis moodustub juba pastöriseeritud piima dehüdratsiooni teel. Selle protsessi eesmärk on tagada, et piima saaks kauem säilitada.
See lahustunud aine lahustub vees ja tekitab vedelat piima, mida tavaliselt tarbitakse hommikusöögi ajal koos kohvi või mitmesuguste preparaatidega.
Nagu mahla pulbri puhul, peab lahjendatava piima kogus olema väiksem kui veekogus, millesse soovite lahuse valmistada..
Pesuvahend vees
Pesupesude kasutamisel kasutatakse vedelaid või pulbrilisi pesuvahendeid. Need lahustatakse vees, et moodustada lahendus, mis toimib tekstiilmaterjalide desinfitseerimis- ja puhastusvahendina.
Selles lahuses kasutatav lahustunud aine kogus on varieeruv olenevalt detergendi tüübist, sama esitusviisi ja selle komponentide hulgast..
Pesuvahendist ja veest koosnev lahendus võib veepuhastusega kokkupuutumisel olla väga saastav, seega on soovitatav kasutada biolagunevaid detergente, mis võivad väga lühikese aja jooksul laguneda ja mõjutada palju vähem keskkonda..
Želatiin
Želatiin on kõõlustest, sidemetest ja loomade luudest koosnev element. See ühend võib olla pulbrina või lehtedena.
Mõlemal juhul tuleb seda lahustuda kuuma veega, et saavutada lõpptulemus: magus toit, mis sobib ideaalselt magustoiduks ja millel on palju kasu tervisele.
Selle ühendi eelisteks on see, et see soodustab kiiret kudede parandamist ja on põletikuvastane toit. Lisaks sellele on sellel palju valke ja see mängib olulist rolli immuunsüsteemi tugevdamisel.
Väikese päevase koguse želatiini söömine aitab kaasa liigeste taastumisele ja seega osteoporoosi ilmnemisele.
Šokolaad piimas
Šokolaad on element, mis moodustub tänu kakao ja kakaovõi segule. See toit toimib piimaga segatuna, et valmistada seda, mida tavaliselt tuntakse kuuma šokolaadina.
Selle valmistise jaoks kuumutatakse soovitud kogus piima ja lisatakse šokolaad tükid, pulber või vedelik, pidevalt segades.
Selleks, et see lahus lahustuks parimal võimalikul viisil ja vältides tükke, tuleb segu peksida ilma pausita.
Kakaopulber vees
Kakao pulbriga saab valmistada ka kuuma šokolaadi. See soluut moodustub ainult kakao pulbri massist. Erinevalt šokolaadist ei sisalda kakao seda puuvilju.
Kakao võib vees täielikult lahustada, et luua šokolaadimaitseline jook. Sellisel juhul on oluline segu magusamaks muuta suhkru, mee või mõne magusainega; vastasel juhul on tulemus äärmiselt kibe.
Viited
- Lambert, N. ja Mohammed, M. (1993). CXC keemia. Oxford: Heinemann.
- Steen, D. P. (2008). Süsinikdioksiid, karboniseerimine ja täitmistehnoloogia põhimõtted. D. P. Steen, Philip ja P. R. Ashurst (toimetajad), Carbonated Soft Drinks: Formulation and Manufacture, lk. 112-143. Oxford: Blackwell Publishing.
- Mis on õhus? (s / f). UCARi teadushariduskeskus. Välja otsitud 17. oktoobril 2017 eo.ucar.edust
- Veeldatud naftagaas. (2013, 12. juuli). Encyclopædia Britannica.
Välja otsitud 16. oktoobril 2017, britannica.com - Lytle, D. A. ja Schock, M. R. (1996). Stagnatsiooniaeg, kompositsioon, PH ja ortofosfaadiefektid metalli leostumisest messingist. Ohio: USA Keskkonnakaitse Agentuur.
- Crabwee, T. D .; Pelletier, S.J. ja Pruett, T. L. (2001). Kirurgiline antisepsis S. S. Block (redaktor), desinfitseerimine, steriliseerimine ja säilitamine, lk. 919-934. Philadelphia: Lippincott Williams & Wilkins.
- Byrne, R. H. jt (2017, juuni 07). Merevesi. Encyclopædia Britannica. Välja otsitud 17. oktoobril 2017, britannica.com
- Plutowska B. ja Wardencki, W. (2012). Alkohoolsete jookide gaasikromatograafia-olfaktomeetria. J. Piggott (toimetaja), Alkohoolsed joogid: sensoorne hindamine ja tarbijauuringud, lk.101-122. Philadelphia: Woodhead Publishing.
- Mis on udu? (2017, 12. juuli). Met Office (Ühendkuningriik). metoffice.gov.uk
- Helmenstine, A. M ... (2016, 16. veebruar). Mis on äädika keemiline koostis? Välja otsitud 17. oktoobril 2017, thinkco.com
- Phinney, D. J. ja Halstead, J. H. (2017). Hambaravi: üldine lähenemine. Massachusetts: Cengage'i õppimine.
- Britannica, E. (s.f.). Lahus-keemia Välja otsitud britannica.com-st
- Wikipedia. (s.f.). Lahustuvus. Välja otsitud aadressilt en.wikipedia.org
- Classzone (s.f.). Lahendused. Välja otsitud frsd.k12.nj.us
- ChemGuide. (s.f.). Küllastunud lahused ja lahustuvus. Välja otsitud kem.libretexts.org
- Madhusha (s.f.). Lahusti ja soluudi erinevus. Välja otsitud aadressilt pediaa.com.


