Topeltasendusreaktsiooni tüübid ja näited
The topeltasendusreaktsioon, kahekordse nihkumise või metateesi puhul on tegemist kahe ühendi vahelise kahekordse ioonivahetusega, ilma oksüdeerimise või redutseerimiseta. See on üks elementaarsemaid keemilisi reaktsioone.
Uued sidemed moodustuvad ioonide vahelistest suurtest elektrostaatilistest tõmbejõududest. Samuti soodustab reaktsioon stabiilsemate liikide, näiteks veemolekuli moodustumist. Topeltasendusreaktsiooni üldist keemilist võrrandit on kujutatud alumisest pildist.
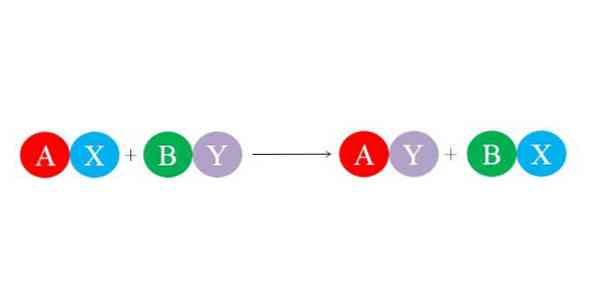
Algühendid AX ja BY reageerivad "oma partnerite" vahetamisega ja moodustavad seega kaks uut ühendit: AY ja BX. See reaktsioon tekib siis ja ainult siis, kui A ja Y on rohkem seotud kui A ja B või kui BX lingid on stabiilsemad kui BY. Kuna reaktsioon on ioonide lihtne vahetamine, siis ükski neist ei kasva ega kaota elektroni (redoksreaktsioon).
Seega, kui A on ühendis AX laengukation +1, siis on ühendil AY sama laeng +1. Sama kehtib ülejäänud "tähtede" kohta. Selline reaktsioon on happe-aluse reaktsioonide toetamine ja sade moodustumine.
Indeks
- 1 tüübid
- 1.1 Neutraliseerimine
- 1.2 Sademed
- 2 Näited
- 2.1 Näide 1
- 2.2 Näide 2
- 2.3 Näide 3
- 2.4 Näide 4
- 2.5 Näide 5
- 2.6 Näide 6
- 2.7 Näide 7
- 2.8 Näide 8
- 3 Viited
Tüübid
Neutraliseerimine
Tugev hape reageerib tugeva alusega, et saada lahustuvaid sooli ja vett. Kui üks kahest - happest või alusest - on nõrk, ei ole toodetud sool täielikult ioniseeritud; see tähendab vesikeskkonnas, mis on võimeline hüdrolüüsima. Sarnaselt võib hapet või alust neutraliseerida soolaga.
Ülaltoodut saab taas esindada keemilise võrrandiga tähtedega AXBY. Kuna Brønstedi happesust näitab ainult H-ioonid+ ja OH-, need esindavad siis tähed A ja Y:
HX + BOH => HOH + BX
See keemiline võrrand vastab neutraliseerimisele, mis on lihtsalt reaktsioon HX-happe ja BOH-aluse vahel, et saada HOH (H2O) ja BX sool, mis võib vees lahustuda või mitte.
Teie skelett võib varieeruda vastavalt stöhhiomeetrilistele koefitsientidele või happe iseloomule (kas orgaaniline või anorgaaniline).
Sademed
Seda tüüpi reaktsioonis on üks saadustest lahustumatu keskkonda, üldiselt vesilahusega ja sadestub (tahke aine tahkestub ülejäänud lahusest)..
Skeem on järgmine: segatakse kaks lahustuvat ühendit AX ja BY ning üks saadustest AY või BX sadestub, mis sõltub lahustuvuse eeskirjadest:
AX + BY => AY (s) + BX
AX + BY => AY + BX (s)
Juhul, kui nii AY kui ka BX olid vees lahustumatud, sadestuvad need ioonide paarid, millel on kõige tugevam elektrostaatiline koostoime, mis võib kvantitatiivselt kajastuda nende lahustuvuskonstandide väärtustes (Kps)..
Enamikus sadestamisreaktsioonides on üks sool lahustuv ja teised sademed. Mõlemad reaktsioonid - neutraliseerimine ja sadestamine - võivad esineda samas ainete segus.
Näited
Näide 1
HCl (ac) + NaOH (ac) => H2O (l) + NaCl (ac)
Milline reaktsioon on? Vesinikkloriidhape reageerib naatriumhüdroksiidiga, mille tulemusena tekib vesi ja naatriumkloriid. Kuna NaCl on vesikeskkonnas väga lahustuv ja moodustati ka veemolekul, on näite 1 reaktsioon neutraliseerimine.
Näide 2
Cu (NO3)2(ac) + Na2S (ac) => CuS (s) + 2NaNO3(ac)
Selles reaktsioonis ei ole H-i ioon olemas+ ega OH-, ja vee molekuli ei täheldata keemilise võrrandi paremal küljel.
Vask (II) nitraat või vasknitraat vahetavad ioone naatriumsulfiidiga. Vasksulfiid on lahustumatu, erinevalt naatriumnitraadist, lahustuv sool.
Cu lahus (NO3)2 see on sinine, samas kui Na on2S on kollakas. Kui mõlemad on segatud, kaovad värvid ja CuS sadestub, mis on mustjas tahke aine.
Näide 3
CH3COOH (ac) + NaOH (ac) => CH3COONa (ac) + H2O (l)
Jällegi on see veel üks neutraliseerimisreaktsioon. Äädikhape reageerib naatriumhüdroksiidiga, moodustades naatriumatsetaatsoola ja veemolekuli.
Erinevalt näitest 1 ei ole naatriumatsetaat sool, mis on täielikult ioniseeritud, kuna anioon hüdrolüüsub:
CH3COO-(ac) + H2O (l) <=> CH3COOH (ac) + OH-(ac)
Näide 4
2HI (ac) + CaCO3s) => H2CO3(ac) + CaI2(ac)
Selles reaktsioonis, mis ei tundu olevat neutraliseeriv, reageerib hüdrodiinhape täielikult lubjakiviga, tekitades süsinikhapet ja kaltsiumjodiidi. Lisaks laguneb soojuse eraldumine (eksotermiline reaktsioon) süsinikhappe süsinikdioksiidiks ja veeks:
H2CO3(ac) => CO2(g) + H2O (l)
Ülemaailmne reaktsioon on järgmine:
2HI (ac) + CaCO3s) => CO2(g) + H2O (l) + CaI2(ac)
Samuti neutraliseerib kaltsiumkarbonaat, aluseline sool, vesinikhapet.
Näide 5
AgNO3(ac) + NaCl (ac) => AgCl (id) + NaNO3(ac)
Hõbenitraat vahetab ioone naatriumkloriidiga, moodustades hõbekloriidi (valkja sademe) ja naatriumnitraadi lahustumatu soola.
Näide 6
2H3PO4(ac) + 3Ca (OH)2(ac) => 6H2O (l) + Ca3(PO4)2s)
Fosforhape neutraliseeritakse kaltsiumhüdroksiidiga, moodustades seega lahustumatu soola kaltsiumfosfaadi ja kuue mooli veemolekule..
See on näide mõlema tüübi topeltasendamise reaktsioonist: happe neutraliseerimine ja lahustumatu soola sadestamine..
Näide 7
K2S (ac) + MgSO4(ac) => K2SO4(ac) + MgS (s)
Kaaliumsulfid reageerib magneesiumsulfaadiga, S-ioonid kokku lahuses2- ja Mg2+ lahustumatu soola magneesiumsulfiidi ja lahustuva soola kaaliumsulfaadi moodustamiseks.
Näide 8
Na2S (ac) + HCI (ac) → NaCl (ac) + H2S (g)
Naatriumsulfid neutraliseerib vesinikkloriidhapet, tekitades naatriumkloriidi ja vesiniksulfiidi.
Selles reaktsioonis ei moodusta vett (erinevalt kõige tavalisematest neutraliseerimistest), vaid mitteelektrolüütilist vesiniksulfiidi molekuli, mille mädanenud munade lõhn on väga ebameeldiv. H2S väljub lahustumisest gaasilises vormis ja ülejäänud liigid on lahustunud.
Viited
- Whitten, Davis, Peck & Stanley. Keemia (8. väljaanne). CENGAGE Learning, p 150-155.
- Quimicas.net (2018). Näited topeltasendamise reaktsioonist. Välja otsitud 28. mail 2018 alates: quimicas.net
- Metateesi reaktsioonid. Välja otsitud 28. mai 2018 kellelt: science.uwaterloo.ca
- Khan Akadeemia. (2018). Kahekordsed asendusreaktsioonid. Välja otsitud 28. mail 2018 kellelt: khanacademy.org
- Helmenstine, Anne Marie, Ph.D. (8. mai 2016). Kahekordse asendamise reaktsioon. Välja otsitud 28. mail 2018, alates: thinkco.com


