Magneesiumhüdriidi valem, keemiline struktuur ja omadused
The magneesiumhüdriid (MgH2 molekulaarse valemiga) on keemiline ühend, mille sisaldus vesinikus on 7,66% ja mis on looduses valge kristalse tahke ainena. Seda kasutatakse peamiselt muude keemiliste ainete valmistamiseks, kuigi seda on uuritud ka kui potentsiaalset vesiniku säilitamiskeskkonda.
See kuulub füsioloogilise lahuse (või ioonse) hüdriidide perekonda, mis on määratletud negatiivselt laetud H-iooniga. Neid hüdriide loetakse leelismetallidest ja leelismuldmetallidest moodustatud hüdriidideks, kuid magneesiumi (ja berülliumi) puhul on lisaks sellele hüdriidide perekonnale iseloomulikele ioonidele ka kovalentsed sidemed..
Indeks
- 1 Valmistamine ja valem
- 2 Keemiline struktuur
- 3 Füüsikalised ja keemilised omadused
- 3.1 Füüsiline
- 3.2 Kemikaalid
- 4 Kasutamine
- 4.1 Vesiniku hoidmine
- 4.2 Hüdrogeenimise ja dehüdrogeenimise reaktsioonid
- 4.3 Muda
- 4.4 Kütuseelemendid
- 4.5 Transport ja energia
- 4.6 Alküülimine
- 5 Riskid
- 5.1 Reageerimine veega
- 5.2 See on pürofoorne
- 6 Viited
Valmistamine ja valem
Magneesiumhüdriid moodustub magneesiumi (Mg) metalli otsese hüdrogeenimise teel kõrge rõhu ja temperatuuri tingimustes (200 atmosfääri, 500 ° C) MgI katalüsaatoriga.2. Selle reaktsioon on samaväärne:
Mg + H2→ MgH2
Samuti on uuritud MgH tootmist2 madalatel temperatuuridel, kasutades kuulveskites toodetud nanokristallilist magneesiumi.
On ka teisi valmistamismeetodeid, kuid need kujutavad endast keerulisemaid keemilisi reaktsioone (magneesium-antratseeni hüdrogeenimine, dietüülmagneesiumi reaktsioon liitiumalumiiniumhüdriidiga ja MgH kompleksi saadus)2).
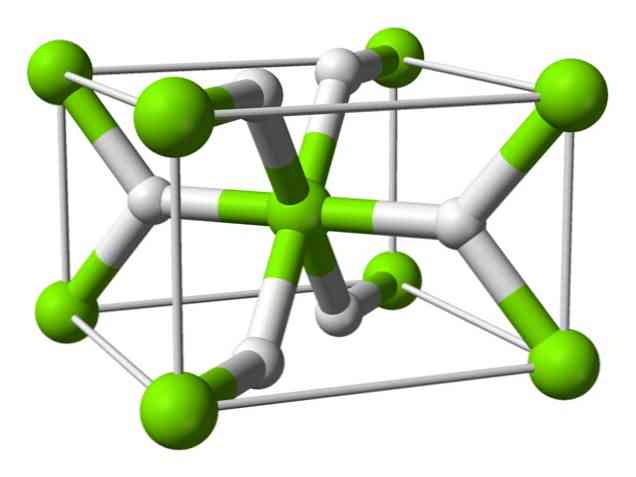
Keemiline struktuur
Sellel aatomil on toatemperatuuril rutiili struktuur, millel on tetragonaalne kristalne struktuur. Sellel on kõrge rõhu tingimustes vähemalt neli erinevat vormi ja täheldatud ka mittestöhhiomeetrilist struktuuri koos vesiniku puudustega; viimane esineb ainult väga väikestes kogustes osakeste moodustumisel.
Nagu eelpool mainitud, on rutiilstruktuuris eksisteerivatel sidemel osaliselt kovalentsed omadused, mitte puhtalt ioonsed, nagu teised soolalahused..
See põhjustab magneesiumi aatomil kerakujulise kuju, täielikult ioniseeritud, kuid selle hüdriidioonil on piklik struktuur.
Füüsikalised ja keemilised omadused
Füüsiline
- Välimus: Valged kristallid.
- Molaarmass: 26,3209 g / mol
- Tihedus: 1,45 g / cm3
- Sulamistemperatuur: 285 ° C laguneb
- Lahustuvus: vees laguneb.
Selle keemilise ühendi molekulmass on 26,321 g / mol, tihedus 1,45 g / cm3 ja sulamistemperatuur on 327 ° C.
Kemikaalid
- Teiste keemiliste ainete valmistamise eellas.
- Vesiniku hoidmine kui võimalik energiaallikas.
- Redutseeriv aine orgaanilises sünteesis.
Oluline on näidata, et seda ühendit ei saa vedelasse olekusse tuua ning kui see on kantud või sulamistemperatuur või vesi viiakse, see laguneb. See hüdriid on eetris lahustumatu.
See on väga reaktiivne ja väga tuleohtlik aine ning on ka pürofoorne, see tähendab, et see võib õhus süttida. Need kolm tingimust on turvariskid, mida mainitakse käesoleva artikli viimases osas.
Kasutamine
Vesiniku säilitamine
Magneesiumhüdriid reageerib kergesti veega, moodustades vesiniku, järgmise keemilise reaktsiooni abil:
MgH2+2H2O → 2H2+Mg (OH)2
Lisaks laguneb see aine temperatuuril 287 ° C ja rõhul 1 bar järgmiselt:
MgH2→ Mg + H2
Seetõttu on välja pakutud magneesiumhüdriidi kasutamine vesiniku hoidmisena selle kasutamiseks ja transportimiseks.
Metallilise magneesiumi koguse hüdrogeenimist ja dehüdrogeenimist pakutakse gaasilise vesiniku koguste transportimise viisina, tagades seeläbi selle, et transpordis ei esine lekkeid ja see oleks ohutum ja praktilisem kui kõrgsurveanumate kasutamisel..
Hüdrogeenimis- ja dehüdrogeenimisreaktsioonid
Kuigi magneesiumhüdriidi lagunemistemperatuur on selle kasutamise piirav tegur, on välja pakutud meetodid hüdrogeenimis- ja dehüdrogeenimisreaktsioonide kineetika parandamiseks. Üks neist on magneesiumosakeste suuruse vähendamine kuulveskite abil.
Muda
Lisaks on välja pakutud süsteem, mis tekitab magneesiumhüdriidi muda kujul (kergemini hallatav ja ohutum kui pulbris või teistes tahketes osakestes), mis reageeriks veega, et saada soovitud vesinik..
Eeldatakse, et eelnevalt nimetatud muda moodustub peeneks jahvatatud hüdriidist, mis on kaitstud õlide kaitsekihiga ja dispergeerivates ainetes suspendeeritud, tagamaks, et see säilitab oma konsistentsi ilma materjali kadumiseta ja et see ei ima keskkonnast niiskust..
Sellel muda eeliseks on see, et seda saab pumbata läbi tavalise diislikütuse, bensiini või veepumba, tehes selle majandusliku ettepaneku ja tõhusaks.
Kütuseelemendid
Magneesiumhüdriidi saab rakendada arenenud kütuseelementide tootmisel ning ka patareide ja energiasalvestuse loomisel.
Transport ja energia
Viimase aastakümne jooksul on kaalutud vesiniku kasutamist energiaallikana. Vesiniku siirdamine kütusena nõuab turvaliste ja pöörduvate ladustamissüsteemide leidmist ning suure mahumahuga (vesiniku kogus mahuühiku kohta) ja gravimeetrilise (vesiniku kogus ühiku kohta) kohta..
Alküülimine
Alküülimine (lisada CH-alküülrühmad3R) orgaanilistest ühenditest aluselises keskkonnas, kus on -OH rühmi madalatel kontsentratsioonidel ja temperatuuridel, mis on kõrgemad kui hüdriidi sulamistemperatuur..
Sel juhul on magneesiumhüdriidis sisalduvad vesinikud (MgH2) ühendage -OH rühmad, mis moodustavad vett. Vaba magneesium võib saada halogeeni, mis sageli kaasneb alküülmolekuliga, mis on mõeldud siduma süsivesinikahelaga.
Riskid
Reaktsioon veega
Nagu juba mainitud, on magneesiumhüdriid aine, mis reageerib veega väga kergesti ja vägivaldselt ning annab võimaluse kõrgematel kontsentratsioonidel plahvatada.
See on tingitud sellest, et selle eksotermiline reaktsioon tekitab piisavalt soojust lagunemisreaktsioonis vabaneva vesinikgaasi süütamiseks, mille tulemuseks on üsna ohtlik ahelreaktsioon..
See on pürofoorne
Magneesiumhüdriid on ka pürofoorne, mis tähendab, et see võib sattuda iseseisvalt niiske õhu juuresolekul ja moodustab magneesiumoksiidi ja vett.
Selle sissehingamine ei ole soovitatav tahkes olekus või kokkupuutel aurudega: aine oma loomulikus olekus ja lagunemissaadused võivad põhjustada tõsiseid vigastusi või isegi surma.
See võib tekitada veega kokkupuutel söövitavaid lahuseid ja saastuda. Kokkupuude naha ja silmadega ei ole soovitatav ning tekitab ka limaskestade ärritust.
Ei ole tõestatud, et magneesiumhüdriid võib tekitada kroonilisi tervisemõjusid, nagu vähk, reproduktiivsed defektid või muud füüsilised või vaimsed tagajärjed, kuid selle käsitsemisel on soovitatav kasutada kaitsevarustust (eriti respiraatorid või maskid). peene tolmu märk).
Selle ainega töötades tuleb õhu niiskus hoida madalal tasemel, kustutada kõik süüteallikad ja transportida see trumlis või muus mahutis..
Alati tuleb vältida selle aine suurte kontsentratsioonidega töötamist, kui seda on võimalik vältida, sest plahvatuse võimalus väheneb oluliselt.
Magneesiumhüdriidi lekke korral tuleb tööpiirkond eraldada ja tolm koguda tolmuimejaga. Sa ei tohi kunagi kasutada kuiva pühkimismeetodit; suurendab hüdridiga reageerimise võimalusi.
Viited
- Zumdahl, S. S. (1998). Encyclopedia Britannica. Britannica.com-lt.
- PubChem. (2005). PubChemi avatud keemia andmebaas. Võetud pubchem.ncbi.nlm.nih.gov.
- Safe Hydrogen, L. (2006). Rohelise auto kongress. Võetud greencarcongress.com'ist.
- Kemikaalid, C. (n.d.). Cameo Chemicals. Võetud cameochemicals.noaa.gov.
- Services, N. J. (1987). New Jersey tervishoiu ja vanemate teenuste osakond. Võetud nj.govist.


