Kaltsiumhüdriidi (CaH2) omadused, reaktiivsus ja kasutusalad
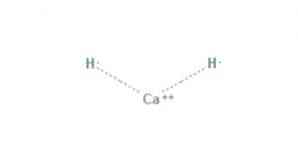
The kaltsiumhüdriid on keemiline ühend valemiga CaH2, mis muudab selle leelismuldade hüdriidiks. Sellel keemilisel ühendil on kaks ioonsidet kaltsiumi ja kahe hüdriidiooni vahel, nagu on näidatud joonisel fig.
See on soolalahus, mis tähendab, et selle struktuur sarnaneb soolaga. Selle kristalne struktuur on sama nagu pliikloriidi (Cotunnite mineraal), nagu on näidatud joonisel 2.

Kõik leelis- ja leelismuldmetallid moodustavad hüdriidsoolasid. Keemias on hüdriidiks vesinik anioon, H- või sagedamini ühend, milles ühel või mitmel vesinikukeskusel on nukleofiilsed, redutseerivad või põhilised omadused..
Ühendites, mida peetakse hüdriidideks, on vesinikuaatom seotud rohkem elektropositiivse elemendiga või rühmaga.
Seda saab valmistada kaltsiumi ja vesiniku reageerimisel temperatuuril vahemikus 300 kuni 400 kraadi. Teine võimalus kaltsiumhüdriidi valmistamiseks on kaltsiumkloriidi kuumutamine koos vesiniku ja naatriummetalliga. Reaktsioon toimub järgmiselt:
CaCl2 + H2 + 2Na → CaH2 + 2NaCl
Selles reaktsioonis moodustavad kaltsium (Ca) ja vesinik (H) kaltsiumhüdriidi molekuli, samal ajal kui naatrium aatomid koos klooriga moodustavad naatriumkloriidi (NaCl) molekule..
Kaltsiumhüdriidi võib valmistada ka kaltsiumoksiidi (CaO) redutseerimisel magneesiumiga (Mg). Reaktsioon viiakse läbi vesiniku juuresolekul. See reaktsioon toodab ka magneesiumoksiidi (MgO). Allpool on toodud selle keemilise reaktsiooni valem:
CaO + Mg + H2 → CaH2 + MgO
Indeks
- 1 Kalsiumhüdriidi füüsikalised ja keemilised omadused
- 2 Reaktiivsus ja ohud
- 3 Käitlemine ja ladustamine
- 4 Kasutamine ja rakendused
- 4.1 Kuivatusaine
- 4.2 Vesiniku tootmine
- 4.3 Vähendav aine
- 5 Kaltsiumhüdriidi kasutamise puudus
- 6 Viited
Kaltsiumhüdriidi füüsikalised ja keemilised omadused
Kaltsiumhüdriid on valge ortroombilise struktuuriga kristallide komplekt, kui see on puhas. Üldiselt on see haruldane leida sellisel kujul, nii et tavaliselt on see hallikas toon. Tal puudub iseloomulik lõhn. Selle välimus on näidatud joonisel 3 (Royal Society of Chemistry, 2015).

Selle molekulmass on 42 094 g / mol, sulamistemperatuur on 816 ° C ja tihedus 1,70 g / ml. Kui see lahustub vees, reageerib see tugevalt vesinikku. Samuti reageerib see alkoholiga (riiklik biotehnoloogia teabe keskus, S.F.)..
Reaktiivsus ja ohud
Kaltsiumhüdriid on stabiilne kemikaal, kuigi see on veele või niiskusele väga reageeriv. Vee kokkupuutel vabastab see tuleohtlikke vesinikugaase, mis võib süttida iseenesest.
Seda peetakse plahvatusohtlikuks ühendiks. Reaktsioonis tetrahüdrofuraaniga kuumutamisel võib see põhjustada plahvatuse. Kloraadi, hüpokloriti, bromaadi, kaaliumparbonaadiga segamisel muutub see tundlikuks kuumuse, hõõrdumise ja plahvatusohtlikkuse suhtes (Calcium Hydride 7789-78-8, 2016).
Kui hõbefluoriid purustatakse kaltsiumhüdriidiga, muutub mass hõõguvaks. Hüdriidi tugev kuumutamine kloori, broomi või joodiga põhjustab hõõrdumist.
Hüdriidi segud erinevate bromaatidega, näiteks baariumbromiidiga või kloraatidega, näiteks baariumkloraat ja perkloraadid, nagu kaaliumperkloraat, plahvatavad tritureerimisel. CaH2 reageerib hõõrdumisega kokkupuutel hõbedasel fluoriidil.
Seda ühendit tuleb käsitseda inertses atmosfääris. Kui seda ei käsitleta nõuetekohaselt, võib see kujutada tõsist ohtu laboritöötajate, päästevestijate ja keemiliste jäätmete käitlejate tervisele ja ohutusele (laborikeskuse laborite ohutus, 2013).
Äärmiselt ohtlik nahale või silma sattumisel, kuna see on ärritav. Väga ohtlik nahaga kokkupuute korral, sest see võib olla söövitav.
Samuti on see allaneelamise ja sissehingamise korral ohtlik. Kudede kahjustuste hulk sõltub kontakti pikkusest. Silma sattumisel võib tekkida sarvkesta kahjustus või pimedus.
Kokkupuude nahaga võib põhjustada põletikku ja villid. Tolmu sissehingamine tekitab seedetrakti või hingamisteede ärritust, mida iseloomustab põletamine, aevastamine ja köha..
Tugev ülemäärane kokkupuude võib põhjustada kopsukahjustusi, lämbumist, teadvusetust ja isegi surma. Silma põletikku iseloomustab punetus, ärritus ja sügelus. Naha põletikku iseloomustab sügelus, koorimine, punetus või mõnikord villid.
Korduv silma sattumine madalale tasemele võib põhjustada silmade ärritust. Korduv kokkupuude nahaga võib põhjustada lokaalset nahakahjustust või dermatiiti.
Tolmu korduv sissehingamine võib põhjustada erineva hingamisteede ärrituse või kopsukahjustuse. Korduv või pikaajaline tolmu sissehingamine võib põhjustada kroonilist hingamisteede ärritust (materjali ohutuskaart Kaltsiumhüdriidi ohutuskaart, 2005).
Silma sattumisel tuleb neid viivitamatult rohke veega vähemalt 15 minuti jooksul loputada, tõstes aeg-ajalt ülemist ja alumist silmalaugu..
Nahale sattumisel tuleb kohe 15 minuti jooksul rohke veega loputada, eemaldades saastunud riided ja jalatsid.
Allaneelamise korral ei tohiks oksendamist esile kutsuda. Tuleks kutsuda mürkide kontrolli keskus. Näitusel on soovitav lahkuda ja sealt kohe välja minna.
Sissehingamise korral, kui hingamine on raske, on vaja hapnikku. Suukaudset hingamist ei tohi manustada, kui kannatanu on ainet alla neelanud või sissehinganud.
Kunstlikku hingamist tuleks indutseerida ühepoolse ventiili või muu sobiva hingamisteede meditsiiniseadmega varustatud tasku maski abil. Kõikidel juhtudel tuleb arstiabi kohe saada.
Käitlemine ja ladustamine
Ühendit tuleb hoida kuumas mahutis eemal kuumusest. Seda tuleb hoida eemal süttimisallikatest. Ärge hingake tolmu sisse. Sellele tootele ei tohi lisada vett
Ebapiisava ventilatsiooni korral kandke sobivat hingamisteede kaitsevahendit, näiteks filtermaski. Kokkupuute korral tuleb pöörduda arsti poole ja näidata etiketti nii palju kui võimalik. Vältida aine sattumist nahale ja silma.
Tuleohtlikke materjale tuleks üldiselt hoida eraldi turvakapis või hoiuruumis. Hoida pakend tihedalt suletuna.
Hoida jahedas ja hästiventileeritud kohas. Kõik seadmed, mis sisaldavad elektrilisi sädemeid, peavad olema maandatud. Mahutit tuleb hoida kuivas ja jahedas kohas.
See on mittesüttiv materjal. Tuletõrjujad peavad siiski kandma sobivat varustust, kust see keemiline ühend kustutab.
Kaltsiumhüdriidi ümbritseva tulekahju kustutamiseks pole kunagi soovitatav kasutada vett. Selleks võib kasutada kuiva liiva, samuti selliseid ühendeid nagu naatriumkloriid ja naatriumkarbonaat.
Kaltsiumhüdriidijäätmete eemaldamiseks tuleb see segada, lisades segades 25 ml metanooli iga grammi hüdriidi kohta lämmastiku atmosfääris..
Kui reaktsioon on lõppenud, lisatakse kaltsiummetoksiidi vesilahusele sama kogus vett ja juhitakse rohke veega äravoolu (National Research Council, 1995)..
Kasutused ja rakendused
Kuivatusaine
Kaaliumhüdriid on suhteliselt kerge kuivatusaine. Seetõttu on selle ühendi kasutamine kuivainena ohutum võrreldes reaktiivsemate ainetega, nagu naatrium-kaalium ja naatriummetalli sulamid. Reageerib veega järgmisel viisil:
CaH2 + 2 H20 → Ca (OH) 2 + 2 H2
Selle reaktsiooni hüdrolüüsi saadused, vesinik (gaas) ja Ca (OH) 2 (vesisegu), võib eraldada keemilisest lahustist pärast filtrimis-, destilleerimis- või dekanteerimisprotsessi..
See keemiline ühend on efektiivne kuivatusaine paljude aluseliste lahustite nagu amiinide ja püridiini jaoks. Mõnikord kasutatakse seda lahustite eelkuivatamiseks enne reaktiivsemate kuivatusainete kasutamist.
Vesiniku tootmine
1940. aastatel oli see ühend vesiniku allikana kaubanime "Hydrolith" all..
Seda on kasutatud pikka aega vesiniku allikana. Seda kasutatakse endiselt puhta vesiniku tootmiseks mitmesuguste katsete, täiustatud kütuseelementide ja aku rakenduste laborites (American Elements, S.F.).
Ühendit on laialdaselt kasutatud aastakümneid ohutu ja mugava vahendina õhupallide paisutamiseks.
Samuti kasutatakse seda laborites regulaarselt väikeste koguste väga puhta vesiniku tootmiseks katseteks. Diislikütuse niiskusesisaldus arvutatakse pärast CaH2-ga töötlemist.
Redutseeriv aine
Kuumutades vahemikus 600 kuni 1000 kraadi Celsiuse järgi, võib nende metallide pulbri valmistamiseks vähendada tsirkooniumoksiidi, nioobiumi, uraani, kroomi, titaani, vanadiini ja tantaali, nii et kaltsiumhüdriidi saab kasutada metallurgias. tolmu.
Järgnev reaktsioon illustreerib, kuidas kaltsiumhüdriid toimib redutseerijana:
TiO + 2CaH2 → CaO + H2 + Ti
Puudus kaltsiumhüdriidi kasutamisel
See keemiline ühend on sageli eelistatud valik kuivatusainena; Siiski on sellel ka mõned puudused:
-Selle ühendi kuivatamine on aeglane, kuna see ei lahustu üheski lahustis, millega ta ei reageeri ägedalt.
-See pulbriline ühend on paljude lahustitega kokkusobimatu. Teie reaktsioon kloorkloriididega võib põhjustada isegi plahvatusi.
-Seda ei saa kasutada lahustite deoksüdeerimiseks, kuna see ei ole võimeline lahustunud hapnikku kõrvaldama.
-Kaltsiumhüdriidi ja kaltsiumhüdroksiidi eristamine on sarnaste ilmingute tõttu üsna raske.
Viited
- Ameerika elemendid. (S.F.). kaltsiumhüdriid. Välja otsitud aadressilt americanelements.com: americanelements.com.
- Kaltsiumhüdriid 7789-78-8. (2016). Välja otsitud aadressilt chemicalbook.com: chemicalbook.com.
- kaltsiumhüdriid. (s.f.). Välja otsitud keemia õppijalt: chemistrylearner.com.
- Kemikaali ohutuskaart Kaltsiumhüdriidi ohutuskaart. (2005, 10. oktoober). Välja otsitud aadressilt sciencelab.com: sciencelab.com.
- Riiklik biotehnoloogia teabekeskus. (S.F.). PubChem Compound andmebaas; CID = 105052. Välja otsitud aadressilt pubchem.ncbi.nlm.nih.gov: pubchem.ncbi.nlm.nih.gov.
- riiklik teadusnõukogu. (1995). Ettevaatlik tegevus laboris: kemikaalide käitlemine ja kõrvaldamine. Washinton: NationalAcademy Press.
- Royal Society of Chemistry. (2015). kaltsiumhüdriidi ID 94784. Välja otsitud chemspider.com-st: chemspider.com.
- UC keskus laboratooriumide ohutuse tagamiseks. (2013, 18. jaanuar). standardne tööprotseduur kaltsiumhüdriid. Välja otsitud aadressilt chemengr.ucsb.edu: chemengr.ucsb.edu.


