Keemilise aktiveerimise energia Mis see koosneb, arvutamine
The keemilise aktiveerimise energia (kineetiliste uuringute seisukohalt) viitab vähim võimalikule kogusele energiale, mis on vajalik keemilise reaktsiooni alustamiseks. Keemilise kineetika kokkupõrke teooria kohaselt öeldakse, et kõigil liikuvatel molekulidel on teatud kineetiline energia.
See tähendab, et mida suurem on teie liikumise kiirus, seda suurem on teie kineetilise energia suurus. Selles mõttes ei saa kiiret liikumist kandvat molekuli iseseisvalt osadeks jaotada, nii et selle ja teise molekuli vahel peab tekkima kokkupõrge, et keemiline reaktsioon toimuks..
Kui see juhtub - kui molekulide vahel tekib kokkupõrge, siis muundub osa selle kineetilisest energiast vibratsioonenergiaks. Samamoodi, kui protsessi alguses on kineetiline energia kõrge, tekivad kokkupõrkes osalevad molekulid nii suureks vibratsiooniks, et mõned keemilised sidemed lõhuvad..
See linkide purustamine on esimene samm reaktiivide muundamisel toodeteks; see tähendab nende moodustamisel. Teisest küljest, kui selle protsessi alguses on kineetiline energia väikese suurusega, ilmneb molekulide "tagasilöögi" nähtus, mille kaudu nad praktiliselt puutumata eralduvad..
Indeks
- 1 Mis see koosneb??
- 1.1 Aktiveeritud kompleks
- 2 Kuidas seda arvutatakse?
- 2.1 Keemilise reaktsiooni aktiveerimisenergia arvutamine
- 3 Kuidas mõjutab aktiveerimisenergia reaktsiooni kiirust?
- 4 Aktiveerimisenergia arvutamise näited
- 5 Viited
Mis see koosneb??
Lähtudes molekulide kokkupõrgete kontseptsioonist, mis on eelnevalt kirjeldatud keemiliste reaktsioonide algatamiseks, võib öelda, et kokkupõrke tekkimiseks on vaja minimaalset energiat..
Niisiis, kui energiasisaldus on sellest vajalikust miinimumist väiksem, ei teki pärast kokkupõrget molekulide vahel mingit muutust, mis tähendab, et kui see energia puudub, jäävad asjaomased liigid praktiliselt puutumata ja ei toimu mis tahes muudatused selle šoki tõttu.
Selles ideede järjekorras nimetatakse aktiveerimisenergiaks minimaalset energiat, mis on vajalik muutuste tekkimiseks pärast molekulide kokkupõrget.
Teisisõnu peab šokis osalevatel molekulidel olema kineetilise energia kogus, mis on võrdne aktiveerimisenergiaga või sellest suurem, nii et keemiline reaktsioon võib tekkida..
Paljudel juhtudel põrkuvad molekulid kokku ja pärinevad uuest liigist, mida nimetatakse aktiveeritud kompleksiks, mida nimetatakse ka "üleminekuteks", sest see eksisteerib ainult ajutiselt.
See on põhjustatud reaktiivi liikidest kokkupõrke tõttu ja enne reaktsiooni produktide moodustumist.
Aktiveeritud kompleks
Ülalmainitud aktiveeritud kompleks moodustab väga madala stabiilsusega liigi, kuid omab omakorda suurt potentsiaalset energiat.
Järgnev diagramm näitab reaktiivide muundumist toodeteks, väljendatuna energias väljendatuna ja märkides, et moodustunud aktiveeritud kompleksi energia suurus on tunduvalt suurem kui reaktantide ja saaduste energia..
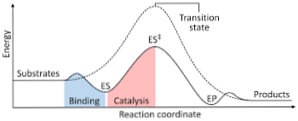
Kui reaktsiooni lõpus on toodetel suurem stabiilsus kui reaktiivi ainetel, toimub energia vabanemine soojuse kujul, andes eksotermilise reaktsiooni..
Vastupidi, kui reaktiivid põhjustavad toodete suuremat stabiilsust, tähendab see, et reaktsioonisegu avaldab energia imendumist soojuse kujul oma ümbrusest, mille tulemuseks on endotermiline reaktsioon..
Samamoodi, kui üks juhtum või teine juhtub, peab olema konstrueeritud skeem, nagu on eelnevalt näidatud, kus on kujutatud süsteemi potentsiaalne energia, mis reageerib reaktsiooni edenemise või edenemise suhtes..
Nii saadakse reaktsiooni jätkumisel tekkivad võimalikud energia muutused ja reaktandid muundatakse toodeteks.
Kuidas seda arvutatakse?
Keemilise reaktsiooni aktiveerimisenergia on tihedalt seotud selle reaktsiooni kiiruskonstandiga ja selle konstantse sõltuvust temperatuurist näitab Arrhenius võrrand:
k = Ae-Ea / RT
Selles väljendis k kujutab reaktsiooni kiiruskonstandit (mis sõltub temperatuurist) ja parameetrit A seda nimetatakse sagedusteguriks ja see on molekulidevaheliste kokkupõrgete sageduse mõõt.
Omalt poolt, e väljendab looduslike logaritmide seeria alust. See tõstetakse võimsusele, mis võrdub aktiveerimisenergia negatiivse osakaaluga (Ea) gaasikonstantist saadava toote vahel (R) ja absoluutne temperatuur (T) süsteemi kaalumist.
Tuleb märkida, et sagedustegurit võib pidada teatud reaktsioonisüsteemides konstantseks laias temperatuurivahemikus.
See matemaatiline väljendus oli algselt ette nähtud Hollandi päritolu keemiku Jacobus Henricus van't Hoffi poolt 1884. aastal, kuid kes andis selle teadusliku kehtivuse ja tõlgendas selle eeldust Rootsi päritolu keemik Svante Arrhenius, aastal 1889.
Keemilise reaktsiooni aktiveerimisenergia arvutamine
Arrhenius'i võrrand osutab otsesele proportsionaalsusele, mis on reaktsiooni kiiruskonstandi ja molekulide vaheliste kokkupõrgete sageduse vahel.
Samuti saab seda võrrandit esitada mugavamal viisil, rakendades loodusliku logaritmi omadust võrrandi mõlemale küljele, saades:
ln k = ln A - Ea / RT
Tingimuste ümberkorraldamisel, et saada liini võrrand (y = mx + b), saavutatakse järgmine väljend:
ln k = (- Ea / R) (1 / T) + ln A
Niisiis, kui ln k ja 1 / T graafik on üles ehitatud, saadakse sirge joon, kus ln k tähistab y-koordinaati, (- A / R) tähistab joone kalle (m), (1 / T) tähistab koordinaati x ja ln A tähistab ristmikku ordinaatide teljega (b).
Nagu näha, on sellest arvutusest tulenev kalle võrdne väärtusega -Ea / R. See tähendab, et kui soovitakse aktiveeriva energia väärtust selle väljenduse abil saada, tuleks läbi viia lihtne puhastamine, mille tulemuseks on:
Ea = -mR
Siin me teame, et m ja R on konstantse väärtusega 8,314 J / K · mol.
Kuidas mõjutab aktiveerimisenergia reaktsiooni kiirust?
Püüdes aktiveerivast energiast pilti teha, võib seda pidada barjääriks, mis ei võimalda reaktsiooni tekkimist madalamate energiamolekulide vahel.
Nagu tavalisel reaktsioonil juhtub, et reageeritavate molekulide arv on üsna suur, võib nende molekulide kiirus ja samaväärne kineetiline energia olla väga varieeruv.
Tavaliselt juhtub, et ainult väike kogus molekule, mis kogevad kokkupõrget - need, kellel on suurem liikumiskiirus -, pakuvad piisavalt kineetilist energiat, et võimendada aktiveerimisenergia suurust. Niisiis on need molekulid sobivad ja võivad olla reaktsiooni osa.
Arrheniuse võrrandi kohaselt tähendab negatiivne märk - mis eelneb aktiveerimisenergia ja gaasikonstanti toote absoluutse temperatuuri vahele -, et kiirusekonstant väheneb, kui aktiveerimisenergia suureneb, samuti kasv, kui temperatuur tõuseb.
Aktiveerimisenergia arvutamise näited
Aktiveerimisenergia arvutamiseks graafiku koostamise teel on Arrheniuse võrrandi kohaselt, et atsetaldehüüdi lagunemisreaktsiooni kiiruskonstandid on mõõdetud viies erinevas temperatuuri juures ja me tahame määrata aktiveerimisenergia reaktsiooni jaoks, mida väljendatakse järgmiselt:
CH3CHO (g) → CH4(g) + CO (g)
Viie mõõtmise andmed on järgmised:
k (1 / M1/2S): 0,011-0,035-0,105-0,343 - 0,789
T (K): 700 - 730 - 760 - 790 - 810
Esiteks, selle tundmatu lahendamiseks ja aktiveerimisenergia määramiseks peame ehitama graafi ln k vs 1 / T (y vs x), et saada sirge ja siit võtta nõlv ning leida väärtus Ea, nagu selgitatud.
Mõõtmiste andmete teisendamine vastavalt Arrhenius'e võrrandile [ln k = (- Ea / R) (1 / T) + ln A] leitakse vastavalt y ja x jaoks järgmised väärtused:
ln k: (-4,51) - (-3,35) - (-2,254) - (-1,070) - (-0,237)
1 / T (K-1): 1,43 * 10-3 - 1,37 * 10-3 - 1,32 * 10-3 - 1,27 * 10-3 - 1,23 * 10-3
Nendest väärtustest ja kalde matemaatilise arvutamise abil - kas arvutis või kalkulaatoris, väljendiga m = (Y2-Y1) / (X2-X1) või kasutades lineaarset regressioonimeetodit - saame, et m = -Ea / R = -2,09 * 104 K. Nii:
Ea = (8,314 J / K · mol) (2,09 * 104 K)
= 1,74 * 105 = 1,74 * 102 kJ / mol
Teiste aktiveerimise energiate määramiseks graafilisel viisil viiakse läbi sarnane protseduur.
Viited
- Wikipedia. (s.f.). Aktiveerimise energia. Välja otsitud aadressilt en.wikipedia.org
- Chang, R. (2007). Keemia, üheksas väljaanne. Mehhiko: McGraw-Hill.
- Britannica, E. (s.f.). Aktiveerimisenergia. Välja otsitud britannica.com-st
- Moore, J. W. ja Pearson, R. G. (1961). Kineetika ja mehhanism. Välja otsitud aadressilt books.google.co.ve
- Kaesche, H. (2003). Metallide korrosioon: füüsikalis-keemilised põhimõtted ja praegused probleemid. Välja otsitud aadressilt books.google.co.ve


