Kalorimeetri ajalugu, osad, tüübid ja nende omadused
The kalorimeeter on seade, mida kasutatakse teatud spetsiifilise soojusega aine (tavaliselt vee) temperatuuri muutuse mõõtmiseks. See temperatuuri muutus on tingitud uuritud protsessis neeldunud või vabanenud soojusest; kui see on reaktsioon, või füüsiline, kui see koosneb faasist või oleku muutusest.
Laboris on lihtsaim kalorimeeter, mis on kohvitassil. Seda kasutatakse püsiva rõhu all reaktsioonis neeldunud või vabanenud soojuse mõõtmiseks vesilahuses. Reaktsioonid valitakse nii, et vältida reaktiivide või gaasiliste toodete sekkumist.
 Eksotermilises reaktsioonis võib vabaneva soojuse koguse arvutada kalorimeetri ja vesilahuse temperatuuri tõusust:
Eksotermilises reaktsioonis võib vabaneva soojuse koguse arvutada kalorimeetri ja vesilahuse temperatuuri tõusust:
Reaktsioonis vabanenud soojuse hulk = kalorimeetri poolt neeldunud soojuse kogus + lahuse neelduva soojuse hulk
Kalorimeetri poolt neelduva soojuse kogust nimetatakse kalorimeetri kalorsuseks. See määratakse kindlaks teatava koguse veega kalorimeetrile teadaoleva koguse soojusega varustamise teel. Seejärel mõõdetakse kalorimeetri ja selle lahuse temperatuuri tõusu.
Nende andmetega ja vee erisoojuse kasutamisega (4,18 J / g ° C) saab arvutada kalorimeetri kalorsuse. Seda võimsust nimetatakse ka kalorimeetriks.
Teisest küljest on vesilahusega saadud soojus võrdne m · ce · Δt-ga. Valemis m = vee mass, ce = vee konkreetne soojus ja Δt = temperatuuri variatsioon. Seda kõike teades saab välja arvutada eksotermilise reaktsiooni poolt vabaneva soojuse.
Indeks
- 1 Kalorimeetri ajalugu
- 2 osa
- 3 Tüübid ja nende omadused
- 3.1 Kohvitass
- 3.2 Kalorimeetriline pump
- 3.3 Adiabaatiline kalorimeeter
- 3.4 Isoperiboolne kalorimeeter
- 3.5 Voolukalorimeeter
- 3.6 Kalorimeeter diferentsiaalse skaneeriva kalorimeetria jaoks
- 4 Rakendused
- 4.1 Füüsikokeemias
- 4.2 Bioloogilistes süsteemides
- 4.3 Hapniku pumba ja kalorite võimsuse kalorimeeter
- 5 Viited
Kalorimeetri ajalugu
1780. aastal kasutas prantsuse keemik A. L. Lavoisier, kes oli üks keemiapatsiente, merisiga, et mõõta oma hingamise abil soojuse tootmist..
Kuidas? Kalorimeetriga sarnase seadme kasutamine. Merisiga toodetud soojust tõestas aparatuuri ümbritseva lume sulamine.
Teadlased A. L Lavoisier (1743-1794) ja P. S. Laplace (1749-1827) kujundasid kalorimeetri, mida kasutati keha konkreetse soojuse mõõtmiseks jää sulamise meetodil..
Kalorimeeter koosnes tina-pinnatud silindrilisest keeduklaasist, lakitud, hoidis statiivi ja sisemiselt lõppes lehtri abil. Sisse paigutati teine klaas sarnaselt eelmisele klaasile, mis läbis väliskambri ja mis oli varustatud võtmega. Teise klaasi sees oli võrk.
Selles võrgus asetati olend või objekt, mille spetsiifilist soojust sooviti määrata. Jää pandi kontsentriliste laevade sisse, nagu ka korvis.
Keha toodetud soojus absorbeeris jää, põhjustades selle sulandumise. Ja koguti jää sulamist suletud vedelprodukt, avades sisemise klaasi võtme.
Ja lõpuks, vee kaalumine, oli teada sulanud jää mass.
Osad
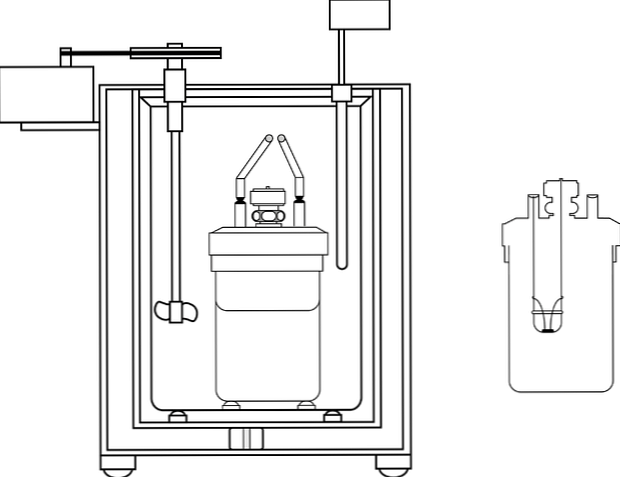
Keemiaõpetuslaborites on kõige sagedamini kasutatav kalorimeeter nn kohvikooki kalorimeeter. See kalorimeeter koosneb keeduklaasist või selle asemel anime materjalist, millel on teatud isoleerivad omadused. Selle mahuti sees asetatakse vesilahus kehasse, mis tekitab või neelab soojust.
Mahuti ülaosas on kaks aukudega isolatsioonimaterjali kaas. Ühes teostatakse temperatuuri muutuste mõõtmiseks termomeetrit ja teiselt poolt segistit, eelistatavalt klaasist materjali, mis täidab vesilahuse sisu liikumise funktsiooni..
Pilt näitab kalorimeetrilise pumba osi; Siiski võib täheldada, et sellel on termomeeter ja segisti, ühised elemendid mitmetes kalorimeetrites.
Tüübid ja nende omadused
Kohvikass
Seda kasutatakse eksotermilisest reaktsioonist vabaneva soojuse määramiseks ja endotermilise reaktsiooni käigus neeldunud soojust..
Lisaks saab seda kasutada keha konkreetse soojuse määramiseks; so soojuse kogus, mida aine gramm peab absorbeerima, et tõsta selle temperatuuri ühe kraadi võrra. .
Kalorimeetriline pump
See on seade, milles mõõdetakse konstantse ruumalaga reaktsioonis vabanenud või neeldunud soojuse kogust.
Reaktsioon toimub tugevas teraspaagis (pumbas), mis on sukeldatud suurtes kogustes vett. See muudab vee temperatuuri muutused väikeseks. Seetõttu eeldatakse, et reaktsiooniga seotud muutused mõõdetakse konstantsel temperatuuril ja mahus.
Ülaltoodu näitab, et tööd ei tehta, kui reaktsioon viiakse läbi kalorimeetrilises pumbas.
Reaktsioon algab pumba külge ühendatud kaablitega varustamise teel.
Adiabaatiline kalorimeeter
Seda iseloomustab see, et sellel on isolatsioonistruktuur, mida nimetatakse kileks. Kilp paikneb raku ümber, kus toimub soojuse ja temperatuuri muutumine. Soojusülekande vältimiseks on see ühendatud ka elektroonilise süsteemiga, mis hoiab temperatuuri väga lähedalt raku temperatuurile.
Adiabaatilisel kalorimeetril on kalorimeetri ja selle ümbruse temperatuuride vahe minimaalne; samuti minimeerida soojusülekande koefitsienti ja soojusvahetuse aega.
Selle osad koosnevad järgmistest osadest:
-Rakk (või konteiner), mis on integreeritud isolatsioonisüsteemi, mille abil püütakse vältida soojuskadu.
-Termomeeter, et mõõta temperatuuri muutusi.
-Kütteseade, mis on ühendatud kontrollitava elektrilise pinge allikaga.
-Ja kilp juba mainitud.
Sellises kalorimeetris on võimalik määrata selliseid omadusi nagu entropia, Debye temperatuur ja elektrooniline oleku tihedus.
Isoperiboolne kalorimeeter
See on seade, milles reaktsioonikamber ja pump pannakse ümbrisesse, mida nimetatakse jope. Sellisel juhul koosneb niinimetatud jope veest, mida hoitakse konstantsel temperatuuril.
Raku ja pumba temperatuur tõuseb, kui põlemisprotsessi käigus eraldub soojus; kuid veeümbrise temperatuuri hoitakse fikseeritud temperatuuril.
Mikroprotsessor kontrollib raku ja jope temperatuuri, tehes vajaliku korrigeerimise lekkeküttest, mis tuleneb kahe temperatuuri erinevustest..
Neid parandusi rakendatakse pidevalt ja lõpliku korrigeerimisega, mis põhinevad enne ja pärast katset.
Voolu kalorimeeter
Caliendar'i poolt välja töötatud seadmel on gaas konteineris liikumiseks konstantsel kiirusel. Soojuse lisamisel mõõdetakse temperatuuri tõusu vedelikus.
Voolu kalorimeetrit iseloomustab:
- Pideva voolukiiruse täpne mõõtmine.
- Kütte kaudu vedelikku juhitava soojuse hulga täpne mõõtmine.
- Energia sisendist põhjustatud gaasi temperatuuri tõusu täpne mõõtmine
- Rõhu all oleva gaasi võimsuse mõõtmise konstruktsioon.
Kalorimeeter diferentsiaalse skaneeriva kalorimeetria jaoks
Seda iseloomustab see, et sellel on kaks konteinerit: ühes proovis asetatakse proov, teine aga tühi või kasutatakse võrdlusmaterjali..
Kaks laeva kuumutatakse konstantsel energiakiirusel kahe sõltumatu kütteseadme abil. Kui kahe konteineri kuumutamine algab, joonistab arvuti kuumutite soojusvoo erinevuse temperatuuriga, et oleks võimalik määrata soojuse voolu..
Lisaks võib määrata temperatuuri varieerumise aja funktsioonina; ja lõpuks ka kalorite võimsus.
Rakendused
Füüsikokeemias
-Põhilised kalorimeetrid, tüüpi kohvimasin, võimaldavad mõõta soojuse kogust, mida keha vabastab või neelab. Nad võivad määrata, kas reaktsioon on eksotermiline või endotermiline. Lisaks saab määrata keha spetsiifilise soojuse.
-Adiabaatilise kalorimeetri abil on olnud võimalik määrata keemilise protsessi ja riigi elektroonilise tiheduse entropiat.
Bioloogilistes süsteemides
-Mikrokalorimeetreid kasutatakse bioloogiliste süsteemide uurimiseks, mis hõlmavad molekulide vahelisi koostoimeid, samuti esinevaid molekulaarseid konformatsioonilisi muutusi; näiteks molekuli avanemisel. Rida sisaldab nii diferentsiaalskaneerimist kui isotermilist tiitrimist.
-Mikrokalorimeetrit kasutatakse väikeste molekulide, bioterapeutikumide ja vaktsiinide ravimite väljatöötamisel.
Hapnikupumba kalorimeeter ja kalorite võimsus
Hapniku pumba kalorimeetris esineb arvukalt aineid põlemist ja selle kütteväärtust saab määrata. Selle kalorimeetri abil uuritud ainete hulgas on: kivisüsi ja koks; söödavad õlid, nii rasked kui ka kerged; bensiin ja kõik mootorikütused.
Lisaks õhusõidukite reaktorite kütuseliikidele; kütusejäätmed ja jäätmete kõrvaldamine; toiduained ja toidulisandid inimeste toitumiseks; söödakultuurid ja loomasööda toidulisandid; ehitusmaterjalid; rakett- ja raketikütused.
Samamoodi on kalorimeetria määratud põletavate materjalide termodünaamilistes uuringutes kalorimeetria abil; ökoloogilise tasakaalu uuringus; lõhkeainetes ja termilistes pulbrites ning põhiliste termodünaamiliste meetodite õpetamisel.
Viited
- Whitten, Davis, Peck & Stanley. Keemia (8. väljaanne). KESKMINE Õppimine.
- González J., Cortés L. & Sánchez A. (s.f.). Adiabaatiline kalorimeetria ja selle rakendused. Taastatud: cenam.mx
- Wikipedia. (2018). Kalorimeeter. Välja otsitud andmebaasist: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (22. juuni 2018). Kalorimeetri määratlus keemias. Välja otsitud andmebaasist: thinkco.com
- Gillespie, Claire. (11. aprill 2018). Kuidas kalorimeeter töötab? Science. Välja otsitud andmebaasist: sciencing.com


