Daltoni postulaatide aatomimudel
The Daltoni aatomi mudel või Daltoni tuumateooria, See oli ettepanek, mille esitasid 1803–1807 inglise keemia ja matemaatik John Dalton. See oli esimene kontseptuaalse organisatsiooni ettepanek aatomite struktuuri ja toimimise kohta.
Daltoni mudelit tuntakse ka sfäärilise mudelina, kuna see teeb ettepaneku, et aatom on jagamatu, tahke ja kompaktne kuul. Tänu sellele mudelile oli ülejäänud maailma jaoks palju lihtsam esitada keemia kohta selgitust ja see oli aluseks paljudele uuenduslikele uurimisprojektidele. Võiks selgitada, miks teatud riikides reageerisid ained.
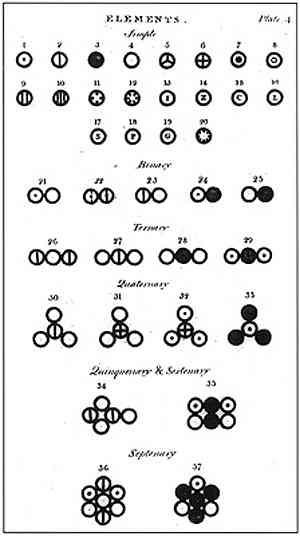
Daltoni sõnul koosnes ainest minimaalne üksus, mida nimetatakse aatomiks, mida ei saanud hävitada ega mingil viisil jagada. See üksus, mida varem pakkus välja Demokraat ja tema mentor Leucipo, oli Daltoni uuringu ja tema aatomi mudeli loomise aluseks.
Selle aatomiteooriaga püüdis John Dalton võtta vastu Kreeka filosoofide ideid aatomi olemasolu kohta (universumi aatomiteooria), kuid kasutades platvormina erinevaid laborikatseid, mis võimaldasid tal näidata oma ideid.
Indeks
- 1 Daltoni aatomimudeli postulaadid
- 1.1. Postulaat 1
- 1.2 Postulaat 2
- 1.3 Postulaat 3
- 1.4 Postulaat 4
- 1.5. Postulaat 5
- 1.6 Postulaat 6
- 2 Daltoni aatomimudeli vead
- 2.1 Vee valem
- 2.2 Aatomite koostis
- 3 Järeldused
- 4 Daltoni peamised panused
- 4.1 Aatomiteooriate eelkäija
- 4.2 Ta pani kaasaegse keemia alused
- 4.3 Kõigepealt avaldada keemiliste kaalude tabel
- 4.4 Andke värvipimedusele nimi
- 5 Huvitavad artiklid
- 6 Viited
Daltoni aatomimudeli postulaadid
Dalton sõnastas oma aatomi mudeli kuue postulaadiga, milles ta selgitab, kuidas ta oma õpinguid ja kuidas ta neid läbi viitas..
Postulaat 1

Ülaltoodud pildil on esitatud Daltoni mudeli kokkuvõte: aatomid oleksid väikesed sfäärid, mis on jagamatud, hävimatud ja homogeensed.
Daltoni esimene postulaat märkis, et elemendid koosnevad pisikestest osakestest, mida nimetatakse aatomiteks, mida ei saa jagada ega hävitada.
Samuti märkis Dalton, et need osakesed ei saa mingis keemilises reaktsioonis muutuda.
Postulaat 2

Daltoni teine postulaat näitas, et kõik samas elemendis olevad aatomid on võrdsed ka teiste omadustega.
Teisest küljest selgus ka, et erinevate elementide aatomitel on erinev mass. Sellest ettepanekust tekkisid teadmised suhtelistest aatommassidest, mida näidati erinevate elementide võrdlemisel vesinikuga.
Postulaat 3

Daltoni kolmas postulaat näitas, et aatomid on jagamatud isegi siis, kui need ühendatakse keemilistes reaktsioonides. Samuti ei saa neid luua ega hävitada.
Aatomite kombinatsioon, mis on võrdne ja erinev, tekitab keerulisemaid ühendeid, kuid see protsess ei muuda asjaolu, et aatom on minimaalne aineühik.
Postulaat 4
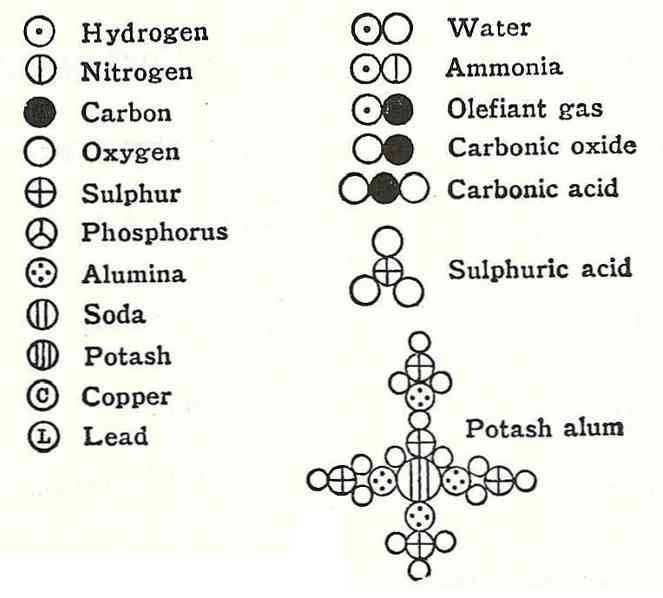
Daltoni neljas postulaat näitas, et isegi kui aatomid on ühendi moodustamiseks ühendatud, on neil alati seos, mida saab väljendada lihtsa ja täieliku numbriga. Seda ekspressiooni ei näidata fraktsioonides, kuna aatomid on jagamatud.
Postulaat 5
Daltoni viies postulaat teatas, et erinevate aatomite kombinatsioonid võivad erineda, moodustades rohkem kui ühe ühendi.
Sel viisil võiks selgitada, et piiratud kogusest aatomitest on kõik universumis olevad asjad tulnud.
Postulaat 6
Daltoni kuues ja viimane postulaat teatas, et iga keemiline ühend loodi kahe või enama erineva elemendi aatomite kombinatsioonist.
Daltoni aatomimudeli vead
Nagu kõik teaduse maailma teooriad, oli Daltoni pakutud mudeli suhtes palju tagasilükkamisi, mida aastate jooksul demonstreeriti, jättes maha Daltoni uuenduslikud ideed..
Vee valem
Selle näiteks oli Daltoni argument vee valemi kohta, mis tema sõnul koosnes vesinikust ja hapnikust.
Selle väite tõttu esines arvukalt arvutusvigu mõnede põhiühendite massi ja kaaluga seoses, mis põhinevad sellel teabel.
Paar aastat hiljem lükkasid Euroopa teadlased Gay-Lussac ja Alexander von Humbodt selle teabe ümber ja tõestasid, et vesi koosneb tegelikult kahest vesinikust ja ühest hapnikust. 6 aastat hiljem tõi Amadeo Avogadro välja vee täpse koostise ja selle tõttu on Avogadro seadus.
Aatomite koostis
Teisest küljest ilmnes kahekümnendal sajandil aatomite tegelik koostis. Sellisel juhul näidati, et on olemas väiksem üksus, nagu prootonid, elektronid ja neutronid.
Samamoodi kerkis esile Mendeleevi ja Meyeri perioodilises tabelis kehtestatud erinevate aatommasside olemasolu, isotoopide olemasolu ja spetsiifilisemad keemilised omadused..
Järeldused
Hoolimata oma vigadest olid John Daltoni panused teadusmaailmas väga olulised ja põhjustasid oma aja jooksul segadust tänu suurele hulgale teabele, mida ta andis.
Teie teaduslikud panused on endiselt kehtivad ja neid uuritakse ikka veel.
Daltoni aatomi mudelit ei ole aastakümneid küsitletud tänu selle tähtsusele teaduse maailmas ja selle õigele selgitusele uurimistööde ja hüpoteeside kohta, mis sel ajal esitati teaduse ajaloos..
Daltoni peamised panused
Tema panus teadusmaailma oli peamiselt looduse hüpoteeside selgitamine ja sõnastamine kvantitatiivsete testide abil.
Teadlane suri südameatakkis 27. juulil 1884 Manchesteris ja peagi pärast monarhia auhindu.
Aatomiteooriate eelkäija
John Dalton oli inglise keemia, matemaatik ja keemik. Ta sündis 6. septembril 1766 Ühendkuningriigis Cumberlandis ja on tuntud kui üks aatomiteooriate eelkäijatest alates hetkest, mil ta oma aatomimudeli esitas..
Ta pani kaasaegse keemia alused
Daltonit tuntakse kui ühte eelkäijat keemiliste elementide suhteliste kaalude tabeli loomisel. See fakt aitas kaasa aluse sellele, mida me tänapäeva keemiana teame.
Kõigepealt avaldada keemiliste kaalude tabel
Dalton oli esimene teadlane, kellel oli au avaldada aatommasside tabel, mis sisaldas selliseid elemente nagu vesinik, hapnik, fosfor, süsinik ja väävel. Tänu sellele publikatsioonile hakkas Dalton töötama ja vormima oma aatomimudelit.
Anna nimi värvipimedusele
Tuleb märkida, et Dalton oli üks esimesi visuaalsete probleemidega registreeritud inimesi värvide püüdmiseks ja temale antud tingimuse tõttu nimetatakse seda värvitooniks.
Huvitavad artiklid
Schrödingeri aatomimudel.
Broglie aatomi mudel.
Chadwicki aatomimudel.
Heisenbergi aatomimudel.
Perrini aatomi mudel.
Thomsoni aatomimudel.
Dirac Jordani aatomimudel.
Demokraatide aatomi mudel.
Bohri aatomimudel.
Viited
- Daltoni tuumateooria. Välja otsitud 24. novembril 2017, Khanacademyst: www.khanacademy.org
- Daltoni Atomiteooria. Välja otsitud 24. novembril 2017 Indiana Ülikoolist Loodeosas: iun.edu
- Aatomiteooria. Välja otsitud 24. novembril 2017, Encyclopædia Britannica: www.britannica.com
- Aatomiteooria. Välja otsitud 24. novembril 2017, Wikipediast: en.wikipedia.org
- Aatomistruktuuri ajalugu. Välja otsitud 24. novembril 2017, Lumen: courses.lumenlearning.com.


