Aine (füüsikalised ja keemilised) iseloomulikud omadused
The aine iseloomulikud omadused need on keemilised või füüsikalised omadused, mis võivad aidata tuvastada või eristada ühte ainet teisest. Füüsikalised omadused on aine tunnused, mida täheldatakse meeltega. Keemilised omadused on omadused, mis kirjeldavad, kuidas aine keemilise reaktsiooni käigus muutub ühest ainest teise.
Mõned aine füüsikalised omadused on tihedus, lahustuvus, sulamispunkt, värvus ja mass. Materjali keemilised omadused on süttivus, reaktsioonivõime hapetega ja korrosioon. Mõned näited selle kohta, kuidas materjali omadused aitavad elementi tuvastada, on erinevate elementide tiheduse võrdlemine.
Element, nagu kuld, on tihedus 19,3 grammi kuupmeetri kohta, samas kui väävli tihedus on 1,96 grammi kuupmeetri kohta. Samamoodi on selliste ainete nagu vesi ja isopropüülalkohol sulamispunktid erinevad.
Aine füüsikalised omadused
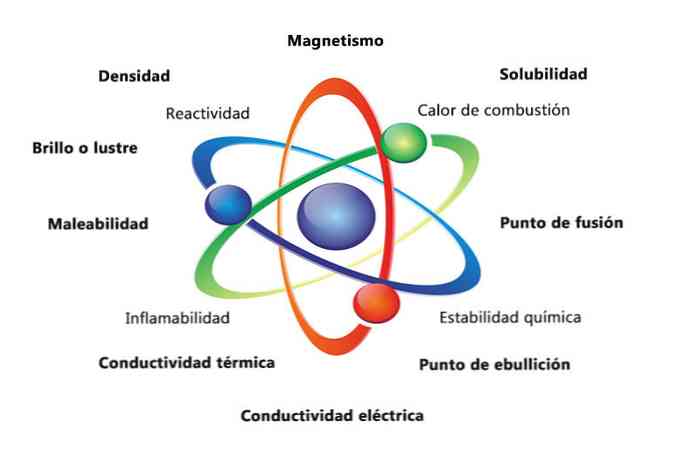
Aine füüsikalised omadused on omadused, mida saab mõõta või jälgida, muutmata aine keemilist olemust. Mõned füüsikaliste omaduste näited on:
- Tihedus: objekti sisaldusega aine kogus arvutatakse massi jagamise teel.
- Magnetism: magneti ja magnetobjekti atraktiivsuse jõud.
- Lahustuvus: mõõdetakse, kui hästi aine võib lahustuda teises aines.
- Sulamistemperatuur: temperatuur, mille juures aine muutub tahkest vedelikuks.
- Keemistemperatuur: temperatuur, mille juures aine muutub vedelikust gaasiks.
- Elektrijuhtivus: mõõdab, kui hästi elektrivool liigub läbi aine.
- Soojusjuhtivus: kiirus, millega aine soojust edastab.
- Malleability: on aine võime rullida või jahvatada mitmel viisil.
- Läikiv või läikiv: kui kergesti objekt peegeldab valgust.
Aine keemilised omadused
Keemilised omadused kirjeldavad aine võimet ise muutuda uueks aineks, millel on erinevad omadused. Allpool on toodud mõned keemiliste omaduste näited:
- Põlemise soojus: energia, mis vabaneb, kui ühendil tekib täielik põlemine hapnikuga.
- Keemiline stabiilsus: viitab sellele, kas ühend reageerib vee või õhuga (keemiliselt stabiilsed ained ei reageeri).
- Süttivus: ühendi võime leegiga kokkupuutel põletada.
- Reaktsioonivõime: võime suhelda teise ainega ja moodustada üks või mitu uut ainet.
Aine füüsilised olekud
Aine on midagi, mis hõivab ruumi, millel on mass ja mida meie meeled tajuvad. Aine võib liigitada vastavalt selle füüsikalisele olekule: tahke, vedel ja gaasiline.
1- Tahked ained ja nende iseloomulikud omadused
Kõigil tahketel ainetel on mass, hõivatud ruum, millel on kindel ruumala ja kuju, ei libise läbi ruumi ja neid ei ole võimalik kokku suruda või jäigast vormist. Näiteks on meil puit, raamatud, käsnad, metall, kivid jne..
Tahketes ainetes on väikesed osakesed väga lähedal ja puudutavad üksteist. Osakesed on nii lähedased, et nad ei saa palju liikuda, nende vahel on väga vähe ruumi.
2 - Vedelikud ja nende iseloomulikud omadused
Kõigil vedelikel on mass, ruum, ruumala, kuid mitte kindel kuju (kuna nad kohanduvad mahutiga, kus nad on), võivad nad olla väga väikese mahuga kokkusurutud ja võivad ruumi läbi libistada. Näidetena on meil: vesi, petrooleum, õli jne..
Vedelikes on väikesed osakesed üksteisest veidi kaugemal, nende vahel on rohkem ruumi (võrreldes tahkete ainetega) ja nad ei puutu üksteisega kokku. Seetõttu võivad osakesed liikuda ruumide vahel, surudes ja kokkupõrkes teiste osakestega, pidevalt muutuvas suunas.
3 - gaasid ja nende iseloomulikud omadused
Kõigil gaasidel on mass, mahub ruumi, neil ei ole kindlaksmääratud mahtu ega kuju, neid saab suurel määral kokku suruda ja ruumi hajutada. Meie näited on: vesinik, hapnik, lämmastik, süsinikdioksiid, auru jne..
Gaasides on väikesed materjaliosakesed palju kaugemal, nende vahel on palju rohkem ruumi (võrreldes vedelikega) ja nad ei puutu omavahel kokku. Osakestel on maksimaalne liikumisvabadus, nii et nad suruvad ja põrkuvad teiste osakestega pidevalt muutuvas suunas.
Olukorra muutused
Materjali võib tahkest olekust muuta vedelaks olekuks ja vastupidi ning vedelast olekust gaasilisse olekusse ja vastupidi. See konversioon võtab küsimuse oleku muutuse nime ja toimub temperatuuri muutumise tõttu:
Fusion
Materjali oleku muutus tahkelt vedelikuks temperatuuri tõusu abil. Kui tahket ainet kuumutatakse, põhjustab soojus osakeste vibratsiooni tugevama.
Sulamispunktini jõudmisel on tahketel osakestel piisav kineetiline energia, et ületada fikseeritud asendis neid hoiavad energiajõud ja nad purunevad, moodustades väikesi vedelate osakeste rühmi..
Keetmine või aurustamine
Vedeliku oleku muutus gaasiliseks temperatuuri tõstmise teel. Vedeliku kuumutamisel muudab soojus osakesed veelgi kiiremaks.
Keemistemperatuurini jõudmisel on vedelatel osakestel piisav kineetiline energia, et ületada atraktsioonijõud, mis hoiavad neid fikseeritud asendis ja eralduvad üksikuteks gaasilisteks osakesteks..
Külmutamine või tahkestamine
Vedeliku oleku muutus tahkeks temperatuuri languse abil. Vedeliku jahutamisel kaotavad selle osakesed palju kineetilist energiat. Külmumispunkti jõudmisel peatuvad osakesed liikumast ja vibreerivad fikseeritud asendis, muutudes tahketeks osakesteks.
Veeldamine või kondenseerumine
Gaasilise aine oleku muutus vedelikuks temperatuuri vähenemise teel. Gaasilise aine jahutamisel kaotavad selle osakesed palju kineetilist energiat, mis põhjustab nende ligitõmbamise vedelate osakesteks.
Sublimatsioon
Mõned materjalid muutuvad oma tahkest olekust otse gaasilisse olekusse või vastupidi, läbimata vedelat olekut. Kui neid tahkeid aineid kuumutatakse, liiguvad nende osakesed nii kiiresti, et nad eraldavad täielikult moodustuva auru või gaasi, ja vastupidi, kui protsess toimub gaasilisest tahkele ainele..
Viited
- De Podesta, M. Aine omaduste mõistmine, 2. väljaanne. Suurbritannia: Taylor & Francis.
- Goel A. Olulised riigid. New Delhi: Discovery kirjastus.
- Moore J, Stanitski C. Molekulaarne teadus, 5. väljaanne. Stamford: Cengage'i õppimine.
- Ramakrishna A. Aine olemus, 1. väljaanne. New Delhi: Goyal Brothers Prakashan.
- Reger D, Goode S, Ball D. Keemia. Põhimõtted ja praktika, 3. väljaanne. Kanada: Brooks / Cole, Cengage'i õppimine.
- Shapere D. Matter (füüsika). Välja otsitud andmebaasist: accessscience.com.
- Singh L, Kaur M. Matter meie ümbruses. India: S. Chandi kool.


